Метан — это… Что такое Метан?
Мета́н (лат. Methanum) — простейший углеводород, бесцветный газ (в нормальных условиях) без запаха[2], химическая формула — CH4. Малорастворим в воде, легче воздуха. При использовании в быту, промышленности в метан обычно добавляют одоранты (обычно меркаптаны) со специфическим «запахом газа». Метан нетоксичен и неопасен для здоровья человека[3]. Однако имеются данные, что метан относится к токсическим веществам, действующим на центральную нервную систему[4]. Накапливаясь в закрытом помещении, метан взрывоопасен. Обогащение одорантами делается для того, чтобы человек вовремя заметил утечку газа. На промышленных производствах эту роль выполняют датчики и во многих случаях метан для лабораторий и промышленных производств остается без запаха.
Метан — первый член гомологического ряда насыщенных углеводородов (алканов), наиболее устойчив к химическим воздействиям. Подобно другим алканам вступает в реакции радикального замещения (галогенирования, сульфохлорирования, сульфоокисления, нитрования и др.), но обладает меньшей реакционной способностью. Специфична для метана реакция с парами воды, которая протекает на Ni/Al
Взрывоопасен при концентрации в воздухе от 4,4 % до 17 %[5]. Наиболее взрывоопасная концентрация 9,5 %. Является наркотиком; действие ослабляется ничтожной растворимостью в воде и крови. Класс опасности — четвёртый[6].
Источники
Основной компонент природных (77—99 %), попутных нефтяных (31—90 %), рудничного и болотного газов (отсюда другие названия метана — болотный или рудничный газ). В анаэробных условиях (в болотах, переувлажнённых почвах, рубце жвачных животных) образуется биогенно. Получается также при коксовании каменного угля, гидрировании угля, гидрогенолизе углеводородов в реакциях каталитического риформинга.
Классификация по происхождению:
- абиогенный — образован как результат химических реакций неорганических соединений;
- биогенный — образован как результат химической трансформации органического вещества;
- бактериальный (микробный) — образован в результате жизнедеятельности бактерий;
- термогенный — образован в ходе термохимических процессов.
Предположительно, что на поверхности Титана (спутник Сатурна) в условиях низких температур (−180 °C) существуют целые озёра и реки из жидкой метано[источник не указан 27 дней]-этановой смеси.
Получение
В лаборатории получают нагреванием натронной извести (смесь гидроксидов натрия и кальция) или безводного гидроксида натрия с ледяной уксусной кислотой.
Для этой реакции важно отсутствие воды, поэтому и используется гидроксид натрия, так как он менее гигроскопичен.
Возможно получение метана сплавлением ацетата натрия с гидроксидом натрия[7]:
Также для лабораторного получения метана используют гидролиз карбида алюминия или некоторых металлорганических соединений (например, метилмагнийбромида).
Химические свойства
Горит в воздухе голубоватым пламенем, при этом выделяется энергия около 39 МДж на 1 м³. С воздухом образует взрывоопасные смеси при объёмных концентрациях от 5 до 15 процентов. Точка замерзания −184oС (при нормальном давлении)
Вступает с галогенами в реакции замещения, которые проходят по свободно радикальному механизму:
Выше 1400 °C разлагается по реакции:
Окисляется до муравьиной кислоты при 150—200 °C и давлении 30—90 атм. по цепному радикальному механизму:
Соединения включения
Метан образует соединения включения — газовые гидраты, широко распространенные в природе.Применение метана
- Топливо.
- Сырьё в органическом синтезе.
Физиологическое действие
Метан является самым физиологически безвредным газом в гомологическом ряду парафиновых углеводородов. Физиологическое действие метан не оказывает и не ядовит (из-за малой растворимости метана в воде и плазме крови и присущей парафинам химической инертности). Погибнуть человеку в воздухе, с высокой концентрацией метана можно только от недостатка кислорода в воздухе для дыхания при очень высоких концентрациях метана. Так, при содержании в воздухе 25—30 % метана появляются первые признаки асфиксии (учащение пульса, увеличение объёма дыхания, нарушение координации тонких мышечных движений и т. д.). Более высокие концентрации метана в воздухе вызывают у человека кислородное голодание — головную боль, одышку, — симптомы, сходные с горной болезнью.
Так как метан легче воздуха, он не скапливается в проветриваемых подземных сооружениях. Поэтому весьма редки случаи гибели людей от вдыхания смеси метана с воздухом, от асфиксии.
Первая помощь при тяжелой асфиксии: удаление пострадавшего из вредной атмосферы. При отсутствии дыхания немедленно (до прихода врача) искусственное дыхание изо рта в рот. При отсутствии пульса — непрямой массаж сердца.
Хроническое действие метана
У людей, работающих в шахтах или на производствах, где в воздухе присутствуют в незначительных количествах метан и другие газообразные парафиновые углеводороды, описаны заметные сдвиги со стороны вегетативной нервной системы (положительный глазо-сердечный рефлекс, резко выраженная атропиновая проба, гипотония) из-за весьма слабого наркотического действия этих веществ, сходного с наркотическим действием диэтилового эфира.
Метан и экология
Является парниковым газом, в этом отношении, более сильным, чем углекислый газ, из-за наличия глубоких вращательных полос поглощения его молекул в инфракрасном спектре. Если степень воздействия углекислого газа на климат условно принять за единицу, то парниковая активность метана составит 21 единицу [8].
ПДК метана в воздухе рабочей зоны составляет 7000 мг/м3[9].
Ссылки
Примечания
- ↑ Обзор: Растворимость некоторых газов в воде
- ↑ Статья «Метан» на сайте «Химик»
- ↑ З. Гауптман, Ю. Грефе, Х. Ремане «Органическая химия», М. «Химия», 1979, стр. 203.
- ↑ Куценко С. А. Основы токсикологии / С.А. Куценко. — СПб.: Фолиант, 2004.
- ↑ ГОСТ Р 52136-2003
- ↑ Газохроматографическое измерение массовых концентраций углеводородов: метана, этана, этилена, пропана, пропилена, н-бутана, альфа-бутилена, изопентана в воздухе рабочей зоны. Методические указания. МУК 4.1.1306-03 (УТВ. ГЛАВНЫМ ГОСУДАРСТВЕННЫМ САНИТАРНЫМ ВРАЧОМ РФ 30.03.2003)
- ↑ Б. А. Павлов, А. П. Терентьев. Курс органической химии. — Издание шестое, стереотипное. — M.: Химия, 1967. — С. 58.
- ↑ EBRD Methodology for Assessment of Greenhouse Gas Emissions, Version 3 February 2009 (англ.)
- ↑ Гигиенические нормативы ГН 2.2.5.1313-03 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны»
Таблица. Молярная масса газов (г/моль = кг/кмоль) от азота до хлористого этила.
|
Химические свойства метана, формула, плотность, горение газа, молярная масса, применение в промышленности, термическое разложение, бромирование метана, строение молекулы

Химические свойства метана ничем не отличаются от свойств, присущих всем веществам класса алканов. В школьном курсе химии метан изучают одним из первых веществ органики, так как он является одним из простейших представителей алканов.
В его составе один атом углерода и четыре атома водорода.
Формула метана и способы его получения
| Молекулярная формула метана | Структурная формула метана |
| СH4
| Н | Н — С — Н | Н |
Метан в больших количествах содержится в атмосфере. Мы не обращаем внимания на нахождение этого газа в воздухе, ведь на нашем организме это никак не отражается, а вот канарейки очень чувствительны к метану.
Когда-то они даже помогали шахтерам спускаться под землю. Когда процентное содержание метана изменялась, птицы переставали петь. Это служило сигналом для человека, что он спустился слишком глубоко и нужно подниматься наверх.

Образуется метан в результате распада остатков живых организмов. Не случайно с английского methane переводится, как болотный газ, ведь он может быть обнаружен в заболоченных водоемах и каменноугольных шахтах.
Основным источником газа в агропромышленном комплексе является рогатый скот. Да, метан они выводят из организма вместе с остальными продуктами жизнедеятельности. Кстати, увеличение числа рогатого скота на планете может привести к разрушению озонового слоя, ведь метан с кислородом образуют взрывоопасную смесь.
Метан в промышленности можно получить с помощью нагревания углерода и водорода или синтеза водяного газа, все реакции протекают в присутствии катализатора, чаще всего никеля.

В США разработана целая система по добыче метана, она способна извлечь до 80% газа из природного угля. На сегодняшний день мировые запасы метана оцениваются экспертами в 260 триллионов метров кубических! Даже запасы природного газа значительно меньше.
В лаборатории метан получают путем взаимодействия карбида алюминия (неорганическое соединение алюминия с углеродом) и воды. Также с помощью гидроксида натрия, вступающего в реакцию с ацетатом натрия, более известного как пищевая добавка Е262.
Физические свойства метана
Характеристика:
- Бесцветный газ, без запаха.
- Взрывоопасен.
- Нерастворим в воде.
- Температура кипения: -162oC, замерзания: -183°C.
- Молярная масса: 16,044 г/моль.
- Плотность: 0,656 кг/м³.
Химические свойства метана
Говоря о химических свойствах, выделяют те реакции, в которые вступает метан. Ниже они приведены вместе с формулами.
Горение метана
Как все органические вещества, метан горит. Можно заметить, что при горении образуется голубоватое пламя.
СН4 + 2O2 → СO2↑ + 2Н2O
Называется такая реакция – реакцией горения или полного окисления.
Замещение
Метан также реагирует с галогенами. Это химические элементы 17 группы в периодической таблице Менделеева. К ним относятся: фтор, хлор, бром, йод и астат. Реакция с галогенами называется – реакцией замещения или галогенирования. Такая реакция проходит только в присутствии света.
Хлорирование и бромирование
Если в качестве галогена используется хлор, то реакция будет называться – реакцией хлорирования. Если в качестве галогена выступает бром, то – бромирование, и так далее.
CH4 + Cl2 → CH3Cl + НСl
CH4 + Br2 → CH3Br + НBr
Хлорирование. Низшие алканы могут прохлорировать полностью.
CH4 + Cl2 → CH3Cl + НСl
CH3Cl + Cl2 → CH2Сl2 + НСl
CH2Сl2+ Cl2 → CHCl3 + НСl
CHCl3 + Cl2 → CСl4 + НСl
Точно так же метан может полностью вступать в реакцию бромирования.
CH4 + Br2 → CH3Br + Н Br
CH3Br + Br2 → CH2Br2 + НBr
CH2Br2 + Br2 → CHBr3 + НBr
CHBr3 + Br2 → CBr4 + НBr
С йодом такой реакции уже нет, а с фтором наоборот сопровождается быстрым взрывом.
Разложение
Так же этому углеводороду свойственна реакция разложения. Полное разложение:
СН4 → С + 2H₂
И неполное разложение:
2СН4 → С2Н2 + 3Н2
Реакция с кислотами
Метан реагирует с концентрированной серной кислотой. Реакция носит название сульфирования и происходит при небольшом нагревании.
2СН4 + Н2SО4 → СН3SО3Н + Н2О
Окисление
Как уже было сказано, СH4 может полностью окисляться, но при недостатке кислорода возможно неполное окисление.
2СН4 + 3O2 → 2CO + 4Н2O
СН4 + О2 → С + 2Н2O
Помимо прочего для этого газа характерно каталитическое окисление. Оно происходит в присутствии катализатора. При разном соотношении моль вещества получаются разные конечные продукты реакции. В основном это:
Реакция протекает при температуре 1500°C. Данная реакция также носит название – крекинг – термическое разложение.
Нитрование метана
Существует также реакция нитрования или реакция Коновалова, названная в честь ученого, который доказал, что с предельными углеводородами действует разбавленная азотная кислота. Продукты реакции получили название – нитросоединения.
CH4 + НNО3 → СН3NO2 + H2O
Реакция проводится при температуре 140-150°C.
Дегидрирование метана
Кроме того, для метана характерна реакция дегидрирования (разложения) – отцепление атомов водорода и получения ацетилена, в данном случае.
2CН4 → C2H2 + 3Н2
Применение метана
Метан, как и остальные предельные углеводороды, широко используется в повседневной жизни. Его применяют в производстве бензина, авиационного и дизельного топлива.
Используют в качестве базы для получения различного органического сырья на предприятиях. Также метан широко используется в медицине и косметологии.

Метан применяют для получения синтетического каучука, красок и шин.
Атлеты используют так называемый жидкий метан для быстрого набора массы за короткий промежуток времени.
А при хлорировании метана образуется вещество, которое в дальнейшем используется для обезжиривания поверхностей или как компонент в средствах для снятия лака. Некоторое время продукт взаимодействия метана и хлора использовали в качестве наркоза.
Плотность метана. Свойства газов метанового ряда Cnh3n+2
В таблице указана плотность метана при различных температурах, включая плотность этого газа при нормальных условиях (при 0°С). Также приведены его теплофизические свойства и характеристики других газов метанового ряда.
Представлены следующие теплофизические свойства газов метанового ряда: коэффициент теплопроводности λ, динамическая вязкость η, число Прандтля Pr, кинематическая вязкость ν, массовая удельная теплоемкость Cp, отношение теплоемкостей (показатель адиабаты) k, коэффициент температуропроводности a и плотность газов метанового ряда ρ. Свойства газов даны при нормальном атмосферном давлении в зависимости от температуры — в интервале от 0 до 600°С.
К газам метанового ряда относятся углеводороды с брутто-формулой CnH2n+2 такие, как: метан CH4, этан C2H6, пропан C3H8, бутан C4H10, пентан C5H12, гексан C6H14, гептан C7H16, октан C8H18. Их еще называют гомологический ряд метана.
Плотность газов метанового ряда при увеличении их температуры снижается из-за теплового расширения газа. Такой характер зависимости плотности от температуры свойственен и многим другим газам. Следует также отметить, что плотность газов метанового ряда растет по мере увеличения количества атомов углерода и водорода в молекуле газа (числа n в формуле CnH2n+2).
Наиболее легким газом из рассмотренных в таблице является метан — плотность метана при нормальных условиях равна 0,7168 кг/м3. Метан при нагревании расширяется и становиться менее плотным. Так, например при температуре 0°С и 600°С, плотность метана отличается приблизительно в 3 раза.
Теплопроводность газов метанового ряда снижается при увеличении числа n в формуле CnH2n+2. При нормальных условиях она изменяется в диапазоне от 0,0098 до 0,0307 Вт/(м·град). По данным в таблице следует, что наибольшей теплопроводностью обладает такой газ, как метан — его коэффициент теплопроводности, например при 0°С, равен 0,0307 Вт/(м·град).
Наименьшая теплопроводность (0,0098 Вт/(м·град) при 0°С) свойственна газу октану. Следует отметить, что при нагревании газов метанового ряда их теплопроводность увеличивается.
Удельная массовая теплоемкость газов, входящих в гомологический ряд метана при нагревании увеличивается. Также увеличивают свои значения такие их свойства, как вязкость и температуропроводность.
Источник:
Казанцев Е. И. Промышленные печи. Справочное руководство для расчетов и проектирования.
Метандростенолон (Данабол) — курс — SportWiki энциклопедия
Южаков Антон МЕТАН описание препарата, эффекты, действие и дозировки Метандростенолон (таблетки по 5 мг) Methanogerот Gerth Pharmaceuticals
(таблетки по 10 мг)
Метандростенолон (сленговое название: Метан) — применяемый внутрь анаболический стероид изначально синтезированный доктором John Ziegler и выпущенный в США в начале 60-х годов прошлого века компанией Ciba.[1]. Изначально метандростенолон использовался для ускорения восстановления и лечения ожогов и даже для повышения общего тонуса у женщин, а вскоре получил широкое распространение в бодибилдинге как средство для увеличения мышечной массы, до тех пор пока его не запретила FDA. Тем не менее Данабол до настоящего времени доступен без предписания в таких странах как Мексика (торговое наименование Reforvit-b), во многих азиатских странах и в странах Восточной Европы (Молдова — Balkan Pharmaceuticals; Румыния — Terapia;). В России метандростенолон продается как Неробол.
Известен также под названиями: Дианабол, Данабол, Неробол, Напосим, DBOL, Метандиенон в бодибилдинге широко распространено сленговое название «Метан». Менее распространенные торговые марки: Methanoger, Анаболин, Бионабол, Дегидрометилтестостерон, Метастенол, Новабол, Перабол, Перболин, Пронабол (pronabol), Стенолон, Анаборал, Ванабол «Dianoget» и многие другие) Появилась инъекционная форма метана Dianoget от Golden Dragon Pharmaceuticals (Гонконг). На сегодняшний день имеется большое количество дискредитирующей информации о Данаболе. Авторы преувеличивают токсические свойства и занижают анаболическую активность. Тем не менее практика показывает, что курс метандростенолона длительностью около 6 недель в дозе 30 мг в сутки может увеличить мышечную массу на 8-10 кг, с последующей потерей 2-5 кг (так называемый феномен отката). Феномен отката можно свести к минимуму, если курс будет составлен правильно.
Метан от Акрихин (старая упаковка)
Данабол по 10 мг (Балкан Фарма)
Легальный статус[править | править код]
Метандиенон, его соли, изомеры, эфиры, все лекарственные формы и торговые названия включены в список сильнодействующих веществ на основании Постановления Правительства Российской Федерации от 29 декабря 2007 г. N 964. Уголовную ответственность влекут за собой: незаконные изготовление, переработка, приобретение, хранение, перевозка или пересылка в целях сбыта, а равно незаконный сбыт, либо оборудования для его изготовления или переработки.
Крупный размер Метандиенона составляет 2,5 г и более.[2]
Methanogerот Gerth Pharmaceuticals
(объем 10ml, 30mg/ml)
Жидкий (инъекционный) «метан»[править | править код]
Жидкий метандростенолон (синонимы: Averbol, Reforvit B, Methastenon, Methanoliq, Metabol-25, и доступные сейчас Methanoger от Gerth Pharmaceuticals, Pharmabol 100 от Pharmacom Labs, Меthanabol от British Dragon, Methandienone от Radjay и Dianoged от Golden Dragon) выпускается в виде суспензии или масляного раствора. Соединение также имеет алкильный радикал в 17 положении, однако по мнению Dan Duchaine, Dave Palumbo и других известных атлетов за счет отсутствия эффекта первичного прохождения может иметь более высокую биодоступность и оказывать меньшее токсическое действие на печень, хотя подтверждения этого отсутствуют. Многие утверждают, что как и в случае с инъекционной формой винстрола токсичность сохраняется. Некоторые приравнивают его к болденону, однако это ошибка.[3]
Инъекционный метандростенолон был популярен во второй половине прошлого века, как более дешевая форма, не требующая оборудования для изготовления таблеток. В настоящее время снова набирает популярность, иногда позиционируясь как средство «нового поколения», однако стоимость неоправданно завышается.
Жидкий метандростенолон можно применять внутрь, имеет отвратительный вкус.[4]
Стероидный профиль[править | править код]
Фармакологическое действие Метандростенолона[править | править код]
- Основной эффект метандростенолона проявляется в быстром увеличении мышечной массы, за счет активации синтеза протеина, гликогенеза.[5]
- Попутно увеличиваются силовые показатели
- Усиливается аппетит
- Незначительно сжигается жир
- Укрепляется костная система
- Метандростенолон имеет относительно слабое андрогенное действие (50% по сравнению с тестостероном), тем не менее оно имеет место быть in vivo.[6]
- В исследованиях было показано, побочные эффекты начинают проявляться в большинстве случаев при превышении дозы Данабола более 30 мг в сутки
Исследование эффектов длительного применения метандиенона[править | править код]
Перевод научной статьи R. J. Shephard[7]
Характеристика атлетов: №, возраст, рост, вес, избыток веса, доза дианаболаИзучены данные 6 бодибилдинг-атлетов. Все принимали матандростенолон (дианабол) самостоятельно. Один из атлетов использовал препарат непрерывно в течение нескольких лет, другие 5 принимали его в течении 7-10 месяцев курсами от 3 недель до 3 месяцев с равными по времени перерывами, чтобы избежать побочных эффектов. Помимо этого употреблялось большое количество протеина, тренировки до 6 раз в неделю по 2-3 часа.
Оценивались показатели крови, функции печени и эндокринной системы, включая уровень тестостерона, ЛГ, ФСГ и другие лабораторные показатели.
Результаты клинических анализов каждого атлета, принимавшего метандиенон:
- Никто из атлетов не отмечал нарушений сексуальной функции.
- Показатели крови были в норме, у одного атлета был повышен гемоглобин и гематокрит.
- Со стороны печени наблюдалось увлечение АСТ и щелочной фосфатазы у 2 испытуемых.
- Уровень тестостерона был ниже нормы у 4 из 6 испытуемых, которые все еще находились на курсе приема.
- ЛГ был значительно понижен у 4 и относительно низкий у 2.
- ФСГ слегка понижен у 3, но существенно повышен у 1.
- Гормон щитовидной железы тироксин в норме.
- У атлета с наибольшим стажем приема дианабола (несколько лет) был повышен холестерин, триглицериды и мочевая кислота.
Гинекомастия
Гинекомастия возникает в результате конверсии части метандростенолона в эстрогены — метилэстрадиол, который имеет на 30% больший аффинитет к эстрогеновым рецепторам. Для предотвращения развития данного побочного эффекта применяются ингибиторы ароматазы. Эти препараты в большинстве случаев позволяют избежать развития гинекомастии.
Токсичность для печени
В виду того, что метандростенолон имеет метильную группу в 17α положении, данный препарат оказывает умеренное токсическое действие на печень. Метильная группа препятствует разрушению Данабола в печени, и дает возможность применять препарат орально (внутрь). Это также снижает связывание Данабола со связывающим половые гормоны глобулином. Применяются желчегонные препараты, такие как Фламин, Тыквеол.
Примечание. Метан, как и любой другой оральный стероидный препарат, при длительном приёме может провоцировать утолщение мембран печёночных клеток, а так же ухудшение проводимости желчевыводящих путей, что может привести к застою желчи и боли в правом боку. Традиционно советуют при употреблении метана параллельно пить препараты типа карсила, эссенциале, лив-52, аллохола или овесола, дабы избежать застоя желчи и «почистить» печень. Эти препараты на самом деле не только не помогают печени во время курса, но и вредят ей. Желчегонные препараты делятся на 2 группы: одни усиливают выработку желчи – холеретики (аллохол,холензим), другие — холекинетики, способствуют ее оттоку из желчного пузыря в кишечник (холосас). Поэтому, если принимать препараты, способствующие образованию желчи, вы только усугубите ситуацию. Поэтому на курсе из желчегонных можно применять только Холосас! А гепатопротекторы (карсил, эссенциале и т.д.) оказывают мембраностимулирующее действие на клетки печени, это в свою очередь приводит к утолщению печеночной стенки и застою желчи, которой трудно диффундировать через толстую мембрану. Так что гепатопротекторы разумнее принимать уже после курса и в этом случае свой выбор лучше остановить на Гептрале и Гепа-мерце (адеметионин).
Задержка жидкости
Еще один довольно распространенный побочный эффект метандростенолона, который связан с эстрогенами. В то же время, задержка жидкости происходит главным образом в мышцах, что создает впечатление большего объема мускулатуры. После окончания курса метандростенолона лишняя жидкость выводится и вес снижается на 10-50% от набранного. Этого не наблюдается при использовании ингибиторов ароматазы.
Другие побочные эффекты метандростенолона
- Повышение артериального давления. Проблему можно решить, если использовать во время курса ингибиторы ароматазы.
- Повышение сексуальной активности во время курса и временное снижение после курса.
- Атрофия яичек возникает при длительных курсах с использованием больших доз Данабола.
- Акне во время курса
- Изжога, ощущение дискомфорта или чувства жара, жжения за грудиной, распространяющегося кверху от эпигастральной (подложечной) области по ходу пищевода. Появление изжоги происходит периодически
- Алопеция (потеря волос)
- У женщин метандростенолон вызывает маскулинизацию.
- В случае злоупотребления или генетической предрасположенности возможно развитие гипертрофии миокарда.
- Гипокоагуляционное состояние со склонностью к кровотечениям, лейкемоидный синдром (лейкоз, боль в длинных трубчатых костях), железодефицитная анемия.
- Прогрессирование атеросклероза (увеличение концентрации ЛПНП и снижение концентрации ЛПВП), периферические отеки.
Способ применения описан на основе литературных источников, представлен исключительно в ознакомительных целях и не является руководством к действию.
Курс метандростенолона проводится атлетами не моложе 21 года для увеличения мышечной массы, при отсутствии противопоказаний (повышенное артериальное давление, заболевания сердца, гипертрофия предстательной железы, заболевания печени и некоторые другие).
- Рекомендуется не превышать суточную дозу более 30 мг. Принимается в 2-3 приема (например 20 мг утром, 10 после обеда). Метан (methandienone) токсичен для печени, и прием препарата лучше всего производить после еды.
- Курс метандростенолона начинается с 10 мг, через 2-3 дня доза постепенно увеличивается до 20-30 мг в сутки (чтобы оценить переносимость). Продолжительность составляет обычно 6 недель.
- Через неделю желательно подключить ингибиторы ароматазы. Например, Анастрозол по 0,5 мг через 3 дня. Это снизит уровень конверсии в эстрогены, и что самое главное устранит скопление жидкости и отечность.
- Через 2-3 дня после курса проводится PCT: тамоксифен, в дозе 20 мг, 2-4 недели. На протяжении последней недели дозировка постепенно сокращается до полной отмены.
- Необходимо следить за артериальным давлением. В случае повышения необходимо снизить дозу, либо начать прием гипотензивных средств (Эналаприл по 5 мг)
- После курса можно использовать тестостероновый бустер на 3-4 недели, для более быстрого восстановления секреции тестостерона в организме и предотвращения феномена отката.
- Не забывайте, что прием анаболических стероидов должен быть согласован с врачом, так как возможны противопоказания.
- Для получения максимального эффекта и снижения потери мышечной массы после курса рекомендуется применять спортивное питание для набора мышечной массы и соблюдать диету для набора мышечной массы.
Также встречаются нетрадиционные схемы приёма метана: интермиттирующий метод, интервальный метод и т.д. и т.п. У каждого из этих вариантов имеются свои задачи. Интермиттирующий метод, например, в теории должен обеспечить работу препарата без какого-либо негативного влияния на выработку эндогенного тестостерона, что на практике не даёт подобного эффекта, и снижение уровня Тесстостерона всё равно имеет место. Интервальный метод предназначен для того, чтобы не вызывать у организма привыкания к действующему веществу и ослабить «давление» на печень. На практике чаще всего эти методы не срабатывают по целому ряду причин, поэтому рекомендовать их не стоит. Метан не подходит для межкурсовых мостов.
Комбинированные курсы Метандростенолона[править | править код]
Учитывая довольно высокую частоту побочных эффектов метандростенолона и узкую широту положительных эффектов, многие авторы рекомендуют использовать данный препарат в сочетании с другими анаболическими стероидами. При этом суточная доза Метандростенолона может колебаться от 10 до 30 мг. Комбинирование позволяет увеличить эффективность курса, вместе с этим снизить частоту побочных эффектов, в виду различной фармакодинамики препаратов.
Для увеличения мышечной массы метандростенолон сочетают следующим образом:
Последние две схемы часто применяют силовики. В комбинированных курсах метандростенолон нередко ставят только на первые 4 недели.
Не рекомендуется применение Метандростенолона без добавления в курс хотя бы терапевтических дозировок препаратов Тестостерона. Помните, что каждая комбинация предполагает строго определенные дозы обоих препаратов и специальный режим приема. Наиболее безопасные курсы анаболических стероидов вы сможете найти в статье: Лучшие курсы стероидов.
Пожалуйста, проголосуйте, если вы использовали данный препарат в своей практике.
Анаболические препараты могут применяться только по назначению врача и противопоказаны детям. Представленная информация не призывает к применению или распространению сильнодействующих веществ и нацелена исключительно на снижение риска осложнений и побочных эффектов.
Плотность метана (Ch5), значение и примеры
Плотность метана и другие его физические свойства
Метан – главная составная часть нефтяного и природного газов. Он применяется как высококалорийное топливо в составе природного газа.
Основные константы метана приведены в таблице ниже.
Таблица 1. Физические свойства и плотность метана.
|
Плотность, кг/м3 |
0,7168 (0oС) 0,6682 (25oС) |
|
Температура плавления, oС |
-182,49 |
|
Температура кипения, oС |
-161,58 |
|
Молярная масса, г/моль |
16,04 |
Химический состав и строение молекулы метана
Химический состав молекулы метана выражается эмпирической формулой CH4. Рассмотрим более подробно её строение, для чего необходимо ввести понятие «гибридизации атомных орбиталей в молекуле».
Гибридизацией называется изменение формы и энергии различных орбиталей одного атома, приводящее к образованию одинаковых (гибридных) орбиталей.
В молекуле метана (рис. 1) гибридизации подвергаются одна s-орбиталь и три p-орбитали атома углерода. Вид и число орбиталей, участвующих в гибридизации определяет её тип. В пространстве эти орбитали расположены относительно друг друга под одинаковыми углами и направлены к вершинам тетраэдра.Тип гибридизации атомов углерода в молекуле метана – sp3.
Рис. 1. Строение молекулы метана.
При образовании молекулы метана sp3— гибридизованные орбитали атома углерода перекрываются с p-орбиталями атомов водорода. Гибридные орбитали атома углерода направлены к вершинам воображаемого тетраэдра, что и объясняет тетраэдрическую форму молекулы метана.
Краткое описание химических свойств и плотность метана
Метан – первый представитель гомологического ряда предельных углеводородов – алканов. Он способен вступать в реакции радикального замещения (галогенирование, нитрование [Коновалова], сульфохлорирование [Рида], сульфоокисление и т.д.), однако ему не свойственна высокая реакционная способность.
Реакция галогенирования метана протекает по цепному механизму и обязательно на свету:
CH4 + Cl2 = CH3Cl + HCl;
CH3Cl + Cl2 = CH2Cl2 + HCl;
CH2Cl2 + Cl2 = CHCl3 + HCl;
CHCl3 + Cl2 = CCl4 + HCl.
Метан, как и другие органические соединения сгорает на воздухе сине-голубоватым пламенем, выделяя при этом значительное количество теплоты:
CH4 + O2 = CO2 + H2O.
Метан используется как сырье для получения целого ряда органических веществ, например метанола, уксусной кислоты, ацетальдегида:
CO + 2H2 = CH3OH.
Примеры решения задач
Алканы — Википедия
Эта статья — о химических соединениях. О канадской алюминиевой компании см. Rio Tinto Alcan.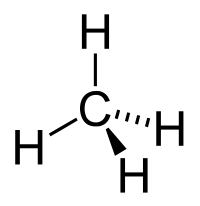 |
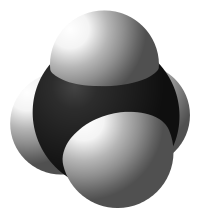 |
| Химическая структура (вверху) и 3D-модель (внизу) метана — простейшего алкана |
Алка́ны (также насыщенные углеводороды, парафины) — ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2.
Все алканы относятся к более крупному классу алифатических углеводородов. Алканы являются насыщенными углеводородами, то есть содержат максимально возможное число атомов водорода для заданного числа атомов углерода. Каждый атом углерода в молекулах алканов находится в состоянии sp3-гибридизации — все 4 гибридные орбитали атома С идентичны по форме и энергии, 4 связи направлены в вершины тетраэдра под углами 109°28′. Связи C—C представляют собой σ-связи, отличающиеся низкой полярностью и поляризуемостью. Длина связи C—C составляет 0,154 нм, длина связи C—H — 0,1087 нм.
Простейшим представителем класса является метан (CH4). Углеводород с самой длинной цепью — нонаконтатриктан C390H782 синтезировали в 1985 году английские химики И. Бидд и М. К. Уайтинг[1].
Рациональная[править | править код]
Выбирается один из атомов углеродной цепи, он считается замещённым метаном, и относительно него строится название «алкил1алкил2алкил3алкил4метан», например:
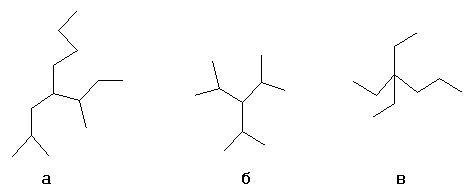
- а: н-бутил-втор-бутилизобутилметан
- б: триизопропилметан
- в: триэтилпропилметан
- б: триизопропилметан
Систематическая ИЮПАК[править | править код]
По номенклатуре ИЮПАК названия алканов образуются при помощи суффикса -ан путём добавления к соответствующему корню от названия углеводорода. Выбирается наиболее длинная неразветвлённая углеводородная цепь, при этом нумерация этой цепи начинается со стороны ближайшего к концу цепи заместителя. В названии соединения цифрой указывают номер углеродного атома, при котором находится замещающая группа или гетероатом, затем название группы или гетероатома и название главной цепи. Если группы повторяются, то перечисляют цифры, указывающие их положение, а число одинаковых групп указывают приставками ди-, три-, тетра-. Если группы неодинаковые, то их названия перечисляются в алфавитном порядке.[2]
Например:
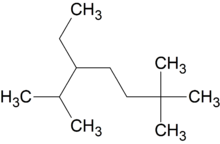 2,6,6-триметил-3-этилгептан (слева направо) / 2,2,6-триметил-5-этилгептан (справа налево)
2,6,6-триметил-3-этилгептан (слева направо) / 2,2,6-триметил-5-этилгептан (справа налево)При сравнении положений заместителей в обеих комбинациях, предпочтение отдается той, в которой первая отличающаяся цифра является наименьшей. Таким образом, правильное название — 2,2,6-триметил-5-этилгептан.
Алканы образуют гомологический ряд.
| Гомологический ряд алканов (первые 10 членов) | ||
|---|---|---|
| Метан | CH4 | CH4 |
| Этан | CH3—CH3 | C2H6 |
| Пропан | CH3—CH2—CH3 | C3H8 |
| Бутан | CH3—CH2—CH2—CH3 | C4H10 |
| Пентан | CH3—CH2—CH2—CH2—CH3 | C5H12 |
| Гексан | CH3—CH2—CH2—CH2—CH2—CH3 | C6H14 |
| Гептан | CH3—CH2—CH2—CH2—CH2—CH2—CH3 | C7H16 |
| Октан | CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH3 | C8H18 |
| Нонан | CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH3 | C9H20 |
| Декан | CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH3 | C10H22 |
Алканы, число атомов углерода в которых больше трёх, имеют изомеры. Изомерия предельных углеводородов обусловлена простейшим видом структурной изомерии — изомерией углеродного скелета, а начиная с C7H16 — также оптической изомерией[3]. Число структурных изомеров алканов CnH2n+2 в зависимости от числа атомов углерода n без учёта стереоизомерии[4][5] и с учётом стереоизомерии[6]:
| n | Число изомеров | С учётом стереоизомерии |
|---|---|---|
| 4 | 2 | 2 |
| 5 | 3 | 3 |
| 6 | 5 | 5 |
| 7 | 9 | 11 |
| 8 | 18 | 24 |
| 9 | 35 | 55 |
| 10 | 75 | 136 |
| 11 | 159 | 345 |
| 12 | 355 | 900 |
| 13 | 802 | 2412 |
| 14 | 1858 | 6563 |
| 15 | 4347 | 18 127 |
| 20 | 366 319 | 3 396 844 |
| 25 | 36 797 588 | 749 329 719 |
| 30 | 4 111 846 763 | 182 896 187 256 |
Число структурных изомеров низших углеводородов до C14H30 было установлено прямым подсчётом; в 1931 году был разработан рекурсивный метод подсчёта числа изомеров[7]. Какой-либо простой связи между числом атомов углерода n и числом изомеров обнаружено не было[7]. При n→1{\displaystyle n\rightarrow {\mathcal {1}}} число различных структурных изомеров алканов можно оценить посредством теоремы Редфилда — Пойи[8].
- Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи
- При стандартных условиях, установленных ИЮПАК (давление 105 Па, температура 0 °C), неразветвлённые алканы с CH4 до C4H10 являются газами, с C5H12 до C13H28 — жидкостями, а начиная с C14H30 и далее — твёрдыми веществами.
- Температуры плавления и кипения понижаются от менее разветвлённых к более разветвлённым. Так, например, при 20 °C н-пентан — жидкость, а неопентан — газ.
- Газообразные алканы горят бесцветным или бледно-голубым пламенем с выделением большого количества тепла.
| n | Название | Тпл, °C | Ткип, °C | Плотность, г/см³ | Показатель преломления |
|---|---|---|---|---|---|
| 1 | Метан | −182,48 | −161,5 | 0,416 при Tкип | |
| 2 | Этан | −183,3 | −88,63 | 0,546 при Tкип | |
| 3 | Пропан | −187,7 | −42,1 | 0,585 при Tкип | |
| 4 | Бутан | −138,35 | −0,5 | 0,6 при Tкип | 1,3326 |
| Изобутан | −159,60 | −11,73 | 0,5510 при Tкип | ||
| 5 | Пентан | −129,7 | 36,07 | 0,6262 | 1,3575 |
| 6 | Гексан | −95,3 | 68,7 | 0,6594 | 1,3749 |
| 7 | Гептан | −90,6 | 98,4 | 0,638 | 1,3876 |
| 8 | Октан | −55,8 | 125,7 | 0,7025 | 1,3974 |
| 9 | Нонан | −54 | 150,8 | 0,718 | 1,4054 |
| 10 | Декан | −29,7 | 174,1 | 0,730 | 1,4119 |
| 11 | Ундекан | −25,6 | 195,9 | 0,7402 | 1,4151 |
| 12 | Додекан | −9,6 | 216,3 | 0,7487 | 1.4216 |
| 13 | Тридекан | −5,4 | 235,5 | 0,7564 | 1,4256 |
| 14 | Тетрадекан | 5,9 | 253,6 | 0,7628 | 1,4289 |
| 15 | Пентадекан | 9,9 | 270,6 | 0,7685 | 1,4310 |
| 16 | Гексадекан | 18,2 | 286,8 | 0,7734 | 1,4345 |
| 17 | Гептадекан | 22,0 | 301,9 | 0,778* | 1,4369* |
| 18 | Октадекан | 28,2 | 316,1 | 0,7819* | 1,4390* |
| 19 | Нонадекан | 32,1 | 329,76 | 0,7855* | 1,4409* |
| 20 | Эйкозан | 36,8 | 342,7 | 0,7887* | 1,4426* |
| 21 | Генэйкозан | 40,5 | 355,1 | 0,7917* | 1,4441* |
| 22 | Докозан | 44,4 | 367,0 | 0,7944* | 1,4455* |
| 23 | Трикозан | 47,6 | 378,3 | 0,7969* | 1,4468* |
| 24 | Тетракозан | 50,9 | 389,2 | 0,7991* | 1,4480* |
| 25 | Пентакозан | 53,7 | 399,7 | 0,8012* | 1,4491* |
| 26 | Гексакозан | 57 | 262 (15 мм рт. ст.) | 0,778 | |
| 27 | Гептакозан | 60 | 270 (15 мм рт. ст.) | 0,780 | |
| 28 | Октакозан | 61,1 | 280 (15 мм рт. ст.) | 0,807 | |
| 29 | Нонакозан | 64 | 286 (15 мм рт. ст.) | 0,808 | |
| 30 | Триаконтан | 65,8 | 446,4 | 0,897* | 1,4536* |
| 31 | Гентриаконтан | 67,9 | 455 | 0,8111* | 1,4543* |
| 32 | Дотриаконтан | 69,7 | 463 | 0,8124* | 1,4550* |
| 33 | Тритриаконтан | 71 | 474 | 0,811 | |
| 34 | Тетратриаконтан | 73,1 | 478 | 0,8148* | 1,4563* |
| 35 | Пентатриаконтан | 74,7 | 486 | 0,8159* | 1,4568* |
| 36 | Гексатриаконтан | 75 | 265 при 130 Па | 0,814 | |
| 37 | Гептатриаконтан | 77,4 | 504,14 | 0,815 | |
| 38 | Октатриаконтан | 79 | 510,93 | 0,816 | |
| 39 | Нонатриаконтан | 78 | 517,51 | 0,817 | |
| 40 | Тетраконтан | 81,4 | 523,88 | 0,817 | |
| 41 | Гентетраконтан | 80,7 | 530,75 | 0,818 | |
| 42 | Дотетраконтан | 82,9 | 536,07 | 0,819 | |
| 43 | Тритетраконтан | 85,3 | 541,91 | 0,820 | |
| 44 | Тетратетраконтан | 86,4 | 547,57 | 0,820 | |
| 45 | Пентатетраконтан | 553,1 | 0,821 | ||
| 46 | Гексатетраконтан | 558,42 | 0,822 | ||
| 47 | Гептатетраконтан | 563,6 | 0,822 | ||
| 48 | Октатетраконтан | 568,68 | 0,823 | ||
| 49 | Нонатетраконтан | 573,6 | 0,823 | ||
| 50 | Пентаконтан | 93 | 421 | 0,824 | |
| 51 | Генпентаконтан | 583 | 0,824 | ||
| 52 | Допентаконтан | 94 | 587,6 | 0,825 | |
| 53 | Трипентаконтан | 592 | 0,825 | ||
| 54 | Тетрапентаконтан | 95 | 596,38 | 0,826 | |
| … | … | … | … | … | … |
| 60 | Гексаконтан | 98,9 | |||
| … | … | … | … | … | … |
| 70 | Гептаконтан | 105,3 | |||
| … | … | … | … | … | … |
| 100 | Гектан | 115,2 | |||
| … | … | … | … | … | … |
| 150 | Пентаконтагектан | 123 | |||
| … | … | … | … | … | … |
| 390 | Нонаконтатриктан | 132 |
Примечание к таблице: * отмечены значения, полученные для переохлаждённой жидкости.
ИК-спектроскопия[править | править код]
В ИК-спектрах алканов четко проявляются частоты валентных колебаний связи С—Н в области 2850—3000 см−1. Частоты валентных колебаний связи С—С переменны и часто малоинтенсивны. Характеристические деформационные колебания в связи С—Н в метильной и метиленовой группах обычно лежат в интервале 1400—1470 см−1, однако метильная группа даёт в спектрах слабую полосу при 1380 см−1.
УФ-спектроскопия[править | править код]
Чистые алканы не поглощают излучение в ультрафиолетовой области выше 2000 Å и по этой причине часто оказываются отличными растворителями для снятия УФ-спектров других соединений.
Алканы имеют низкую химическую активность. Это объясняется тем, что одинарные связи C—H и C—C относительно прочны, и их сложно разрушить. Поскольку связи С—C неполярны, а связи С—Н малополярны, оба вида связей малополяризуемы и относятся к σ-виду, их разрыв наиболее вероятен по гомолитическому механизму, то есть с образованием радикалов.
Реакции радикального замещения[править | править код]
Галогенирование[править | править код]
Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-излучением или нагреть.
Хлорирование метана не останавливается на стадии получения метилхлорида (если взяты эквимолярные количества хлора и метана), а приводит к образованию всех возможных продуктов замещения, от хлорметана до тетрахлорметана. Хлорирование других алканов приводит к смеси продуктов замещения водорода у разных атомов углерода. Соотношение продуктов хлорирования зависит от температуры. Скорость хлорирования первичных, вторичных и третичных атомов зависит от температуры, при низкой температуре скорость убывает в ряду: третичный, вторичный, первичный. При повышении температуры разница между скоростями уменьшается до тех пор, пока не становится одинаковой. Кроме кинетического фактора на распределение продуктов хлорирования оказывает влияние статистический фактор: вероятность атаки хлором третичного атома углерода в 3 раза меньше, чем первичного, и в 2 раза меньше, чем вторичного. Таким образом, хлорирование алканов является нестереоселективной реакцией, исключая случаи, когда возможен только один продукт монохлорирования.
Стоит отметить, что галогенирование происходит тем легче, чем длиннее углеродная цепь н-алкана. В этом же направлении уменьшается энергия ионизации молекулы вещества, то есть, алкан легче становится донором электрона.
Галогенирование — это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атомы галогенируются в последнюю очередь). Галогенирование алканов проходит поэтапно с последовательным образованием хлорметана, дихлорметана, хлороформа и тетрахлорметана: за один этап замещается не более одного атома водорода:
- Ch5+Cl2→Ch4Cl+HCl{\displaystyle {\mathsf {CH_{4}+Cl_{2}\rightarrow CH_{3}Cl+HCl}}}
- Ch4Cl+Cl2→Ch3Cl2+HCl{\displaystyle {\mathsf {CH_{3}Cl+Cl_{2}\rightarrow CH_{2}Cl_{2}+HCl}}}
- Ch3Cl2+Cl2→CHCl3+HCl{\displaystyle {\mathsf {CH_{2}Cl_{2}+Cl_{2}\rightarrow CHCl_{3}+HCl}}}
- CHCl3+Cl2→CCl4+HCl{\displaystyle {\mathsf {CHCl_{3}+Cl_{2}\rightarrow CCl_{4}+HCl}}}
Под действием света молекула хлора распадается на радикалы, затем они атакуют молекулы алкана, отрывая у них атом водорода, в результате этого образуются метильные радикалы ·СН3, которые сталкиваются с молекулами хлора, разрушая их и образуя новые радикалы.
Цепной механизм галогенирования:
1) Инициирование
- Cl:Cl→hνCl·+·Cl{\displaystyle {\ce {\mathsf {Cl{\text{:}}Cl->[{h\nu }]Cl{\text{·}}+{\text{·}}Cl}}}}
2) Рост цепи
- Ch4-Ch3-Ch4+Cl·→Ch4-CH˙-Ch4+HCl{\displaystyle {\mathsf {CH_{3}{\text{-}}CH_{2}{\text{-}}CH_{3}+Cl{\text{·}}\rightarrow CH_{3}{\text{-}}{\dot {CH}}{\text{-}}CH_{3}+HCl}}}
- Ch4-CH˙-Ch4+Cl:Cl→Ch4-CHCl-Ch4+Cl·{\displaystyle {\mathsf {CH_{3}{\text{-}}{\dot {CH}}{\text{-}}CH_{3}+Cl{\text{:}}Cl\rightarrow CH_{3}{\text{-}}CHCl{\text{-}}CH_{3}+Cl{\text{·}}}}}
3) Обрыв цепи
- Ch4-CH˙-Ch4+Cl·→Ch4-CHCl-Ch4{\displaystyle {\mathsf {CH_{3}{\text{-}}{\dot {CH}}{\text{-}}CH_{3}+Cl{\text{·}}\rightarrow CH_{3}{\text{-}}CHCl{\text{-}}CH_{3}}}}
Бромирование алканов отличается от хлорирования более высокой стереоселективностью из-за большей разницы в скоростях бромирования третичных, вторичных и первичных атомов углерода при низких температурах.
Иодирование алканов иодом не происходит, получение иодидов прямым иодированием осуществить нельзя.
С фтором и хлором реакция может протекать со взрывом, в таких случаях галоген разбавляют азотом или подходящим растворителем.
Сульфирование[править | править код]
При одновременном действии на алканы оксидом серы (IV) и кислородом, при ультрафиолетовом облучении или при участии веществ, являющихся донорами свободных радикалов (диазометан, органические перекиси), протекает реакция сульфирования с образованием алкилсульфокислот:
- Ch4-Ch3-Ch3-Ch4→O2;SO2;hνCh4-Ch3-Ch3-Ch3-SO2OH{\displaystyle {\mathsf {CH_{3}{\text{-}}CH_{2}{\text{-}}CH_{2}{\text{-}}CH_{3}{\xrightarrow {O_{2};SO_{2};h\nu }}CH_{3}{\text{-}}CH_{2}{\text{-}}CH_{2}{\text{-}}CH_{2}{\text{-}}SO_{2}OH}}}
Сульфохлорирование (реакция Рида)[править | править код]
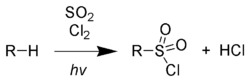 При облучении ультрафиолетовым излучением алканы реагируют со смесью SO2 и Cl2, После того, как с уходом хлороводорода образуется алкильный радикал, присоединяется диоксид серы. Образовавшийся сложный радикал стабилизируется захватом атома хлора с разрушением очередной молекулы последнего.
При облучении ультрафиолетовым излучением алканы реагируют со смесью SO2 и Cl2, После того, как с уходом хлороводорода образуется алкильный радикал, присоединяется диоксид серы. Образовавшийся сложный радикал стабилизируется захватом атома хлора с разрушением очередной молекулы последнего.
Развитие цепного процесса:
- RH+Cl⋅→R⋅+HCl{\displaystyle {\mathsf {RH+Cl\cdot \rightarrow R\cdot +HCl}}}
- R⋅+SO2→RSO2⋅{\displaystyle {\mathsf {R\cdot +SO_{2}\rightarrow RSO_{2}\cdot }}}
- RSO2⋅+Cl2→RSO2Cl+Cl⋅{\displaystyle {\mathsf {RSO_{2}\cdot +Cl_{2}\rightarrow RSO_{2}Cl+Cl\cdot }}}
Легче всего сульфохлорируются углеводы линейного строения, в отличие от реакций хлорирования и нитрования.[9]
Образовавшиеся сульфонилхлориды широко применяются в производстве ПАВ.
Нитрование[править | править код]
Алканы реагируют с 10 % раствором азотной кислоты или оксидом азота NO2 в газовой фазе при температуре 140 °C и небольшом давлении с образованием нитропроизводных:
- RH+HNO3→RNO2+h3O{\displaystyle {\mathsf {RH+HNO_{3}\rightarrow RNO_{2}+H_{2}O}}}
Имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов.
Реакции окисления[править | править код]
- Автоокисление
Окисление алканов в жидкой фазе протекает по свободно-радикальному механизму и приводит к образованию гидропероксидов, продуктов их разложения и взаимодействия с исходным алканом. Схема основной реакции автоокисления:
- RH+O2→R⋅+HOO⋅{\displaystyle {\mathsf {RH+O_{2}\rightarrow R\cdot +HOO\cdot }}}
- R⋅+O2→ROO⋅{\displaystyle {\mathsf {R\cdot +O_{2}\rightarrow ROO\cdot }}}
- ROO⋅+RH→ROOH+R⋅{\displaystyle {\mathsf {ROO\cdot +RH\rightarrow ROOH+R\cdot }}}
- Горение
Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример:
- Ch5+2O2→CO2+2h3O+ΔQ{\displaystyle {\mathsf {CH_{4}+2O_{2}\rightarrow CO_{2}+2H_{2}O+\Delta Q}}}
Значение Q достигает 46 000 — 50 000 кДж/кг.
В случае нехватки кислорода вместо углекислого газа получается оксид углерода(II) или уголь (в зависимости от концентрации кислорода).
- Каталитическое окисление
В реакциях каталитического окисления алканов могут образовываться спирты, альдегиды, карбоновые кислоты.
При мягком окислении СН4 в присутствии катализатора кислородом при 200 °C могут образоваться:
Окисление также может осуществляться воздухом. Процесс проводится в жидкой или газообразной фазе. В промышленности так получают высшие жирные спирты и соответствующие кислоты.
Реакция окисления алканов диметилдиоксираном:
Механизм реакций получения кислот путём каталитического окисления и расщепления алканов показан ниже на примере получения из бутана уксусной кислоты:
Термические превращения алканов[править | править код]
- Разложение
Реакции разложения происходят лишь под влиянием больших температур. Повышение температуры приводит к разрыву углеродной связи и образованию свободных радикалов.
Примеры:
- Ch5→ot>1000oCC+2h3{\displaystyle {\mathsf {CH_{4}{\xrightarrow[{}]{^{o}t>1000^{o}C}}C+2H_{2}}}}
- C2H6→2C+3h3{\displaystyle {\mathsf {C_{2}H_{6}\rightarrow 2C+3H_{2}}}}
- Крекинг
При нагревании выше 500 °C алканы подвергаются пиролитическому разложению с образованием сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции. При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов.
В 1930—1950 гг. пиролиз высших алканов использовался в промышленности для получения сложной смеси алканов и алкенов, содержащих от пяти до десяти атомов углерода. Он получил название «термический крекинг». С помощью термического крекинга удавалось увеличить количество бензиновой фракции за счёт расщепления алканов, содержащихся в керосиновой фракции (10—15 атомов углерода в углеродном скелете) и фракции солярового масла (12—20 атомов углерода). Однако октановое число бензина, полученного при термическом крекинге, не превышает 65, что не удовлетворяет требованиям условий эксплуатации современных двигателей внутреннего сгорания.
В настоящее время термический крекинг полностью вытеснен в промышленности каталитическим крекингом, который проводят в газовой фазе при более низких температурах — 400—450 °C и низком давлении — 10—15 атм на алюмосиликатном катализаторе, который непрерывно регенерируется сжиганием образующегося на нём кокса в токе воздуха. При каталитическом крекинге в полученном бензине резко возрастает содержание алканов с разветвлённой структурой.
Для метана:
- 2Ch5→ot>1500oCC2h3+3h3{\displaystyle {\mathsf {2CH_{4}{\xrightarrow[{}]{^{o}t>1500^{o}C}}C_{2}H_{2}+3H_{2}}}}
Во время крекинга одна из связей (С-С) разрывается, образуя два радикала. Далее одновременно происходят три процесса, вследствие которых реакция дает множество различных продуктов.
- Ch4-Ch3:Ch4→1500∘CCh4-Ch3·+·Ch4{\displaystyle {\mathsf {CH_{3}{\text{-}}CH_{2}{\text{:}}CH_{3}{\xrightarrow {1500^{\circ }C}}CH_{3}{\text{-}}CH_{2}{\text{·}}+{\text{·}}CH_{3}}}}
1) Рекомбинация