Применение метана (Ch5) в быту » Все о транспорте газа
Метан применяется во множестве сфер человеческой жизни. Он обеспечивает прогресс/сохранение уровня цивилизации. Это материал для создания полимеров (синтетического каучука), а затем иных весьма гибких и прочных материалов (резина), химическое сырьё, один из основных источников водорода. Главное же его предназначение всё-таки являться топливом. Газ в этом плане набирает популярность, ибо использовать в этих целях метан экономичнее.
Области применения метана
Метан — топливо автомобилей
- Сейчас метан всё чаще используется, как топливо в автомобилях в качестве. Однако — в сжатом виде, ведь плотность метана значительно меньше, чем у бензина. Обычно его сжимают до состояния от 200 до 250 атмосфер и помещают в баллоны, которые и размещаются в машине. Некоторое падение мощности применение такого топлива всё-таки может вызвать, но оно крайне не существенно. Зато в отличие от бензина стоит CH4 ощутимо дешевле, да и вредных веществ в атмосферу выделяет поменьше. Так же из этого газа можно получать синтетический бензин.
Сварка и резка металла метаном
- Так же метан используется в процессе (газовых) сварки, либо резки металла, в силу способности к горению. Его температура пламени (до 1200 градусов) пониже, чем у ацетилена, поэтому сварка таким газом наиболее подходит для алюминия, меди, её сплавов и чугуна.
Использование метана в быту
Ch5 — основная составляющая природного газа, а значит и большая часть того, что используется в газовых плитах и других подобных конструкциях. Используется в качестве продукта хлорирования в огнетушителях.
Метан в медицине
Он нашёл применение и в медицине. Газ в целом безвреден для человеческого организма, но оказывает на индивидума усыпляющие действие. Поэтому метан используют в качестве снотворного, возможно, с некоторыми примесями.
Метан как растворитель
Используется Ch5 и в качестве растворителя. Вода в этом плане более эффективна, однако этот газ менее химически реактивен и потому способен создавать большие системные образования вроде белков.
Вред: Метан — парниковый газ
Однако не смотря на свою дешевизну, метан имеет большой минус. Он оказывает очень сильное парниковое воздействие на атмосферу, в 21 раз большее, чем оказывает углекислый газ.
Прежде чем задать вопрос прочитайте: FAQМетан ⚗️ структурная формула газа, строение, химические и физические свойства, получение и применение, с какими веществами реагирует углеводород
Краткая характеристика
Природный метан образуется при гниении останков живых организмов. В переводе с английского «methane» означает «болотный газ», так как чаще всего его обнаруживают в болотах и каменноугольных шахтах.
Почти 95% реагента появляется в результате биологических процессов. Пятая часть годовых выбросов газа в атмосферу приходится на коз и коров, в желудках которых живут бактерии, вырабатывающие метан. В атмосферу он попадает, когда рогатый скот выводит из организма продукты своей жизнедеятельности.
Другими источниками вещества являются:
- термиты;
- рис-сырец;
- болотистые водоёмы;
- фильтрация природного газа;
- фотосинтез растений;
- вулканы;
- давно погибшие организмы.
Поскольку вещество обычно связано с живыми организмами, то учёные полагают, что его присутствие на планете указывает на наличие жизни. Так, когда этот газ был обнаружен в атмосферах Марса, специалисты начали тщательное изучение планеты именно на предмет существования живых организмов. Но дальнейшие исследования показали, что на удалённых планетах Солнечной системы метана значительно больше, хотя там он появился в результате химических реакций.
На Земле вещество просачивается через трещины в земной коре, находящиеся на океанском дне, в больших количествах выделяется во время горных разработок и при лесных пожарах. Кроме того, недавно учёными был обнаружен новый источник газа, который никогда ранее в таком ключе не рассматривался.
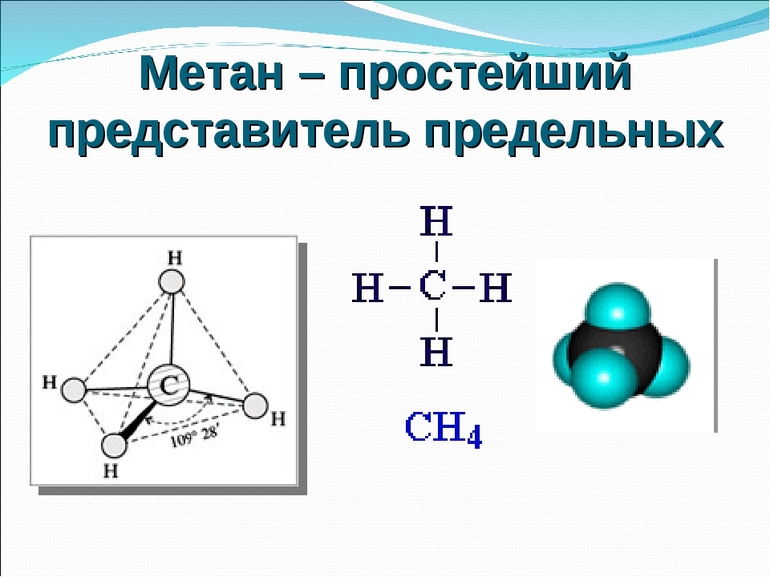
Физические качества
Метан представляет собой самый простой углеводород. Считается, что он имеет специфический запах, но это распространённое заблуждение. Чистый газ не имеет запаха, характерный аромат он приобретает благодаря специальным добавкам, которые добавляют в вещество для предупреждения о его утечке, ведь цвета химическое соединение также не имеет.
Кроме того, к физическим свойствам метана относятся:

- Горение голубым пламенем.
- Сгорание без выделения вредных продуктов.
- Плохая растворимость в воде.
- Он легче воздуха.
- Основная составляющая природных, попутных нефтяных, рудничного и болотного газов.
- Кипение при температуре -161 °C.
- Замерзание при температуре -183 °C.
- Молярная масса составляет 16,044 г/моль.
- Плотность — 0,656 кг/м³.
- При соединении с воздухом образуются взрывоопасные смеси.
- В жидком виде представляет собой бесцветную жидкость без запаха.
Наиболее опасен метан, который выделяется во время подземных разработок полезных ископаемых, а также на фабриках, занимающихся переработкой и обогащением угля. Когда количество газа в воздухе достигает 5−6%, то он начинает гореть рядом с источниками тепла.

Если уровень вещества поднимается до 14−16%, то может произойти взрыв. При увеличении концентрации вещество горит при постоянном поступлении кислорода. Если же в этот момент количество метана начнёт снижаться, то результатом также может стать взрыв. При взрыве огонь, подпитываемый газом, движется со скоростью от 500 до 700 м/сек. Давление же вещества в этот момент в замкнутом пространстве составляет 1 Мн/м2.
При соприкосновении с источником тепла метан воспламеняется с небольшой задержкой. Это свойство вещества применяется при изготовлении предохранительных взрывчатых веществ и электрооборудования, безопасного при взрывах. На всех объектах, где существует опасность выброса метана, действуют правила техники безопасности «газовый режим».
Химические свойства
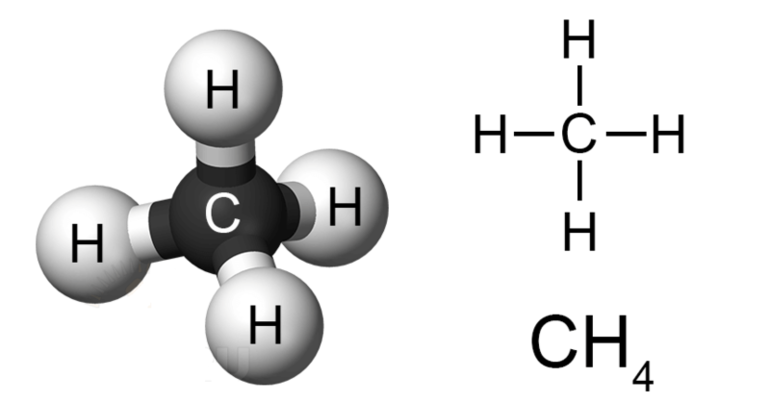
В химии формула метана — Ch5. Соединение плохо вступает в химические связи.
В обычных условиях оно не реагирует со следующими веществами:
- концентрированные кислоты;
- расплавленные и концентрированные щелочи;
- щелочные металлические реагенты;
- галогены;
- перманганат калия;
- дихромат калия в кислой среде.

При температуре около 200 °C и давлении от 30 до 90 атмосфер болотный газ окисляется, преобразуясь в муравьиную кислоту. Вещество образует соединения, называемые газовыми гидратами, которые часто встречаются в природе.
По своим химическим свойствам метан схож с другими реагентами, относящимися к алканам. А потому он вступает в такие химические реакции, как:

- Конверсия в синтез-газ. Синтез-газ, который образуется в результате указанной реакции, используется для получения метанола, углеводородов и так далее.
- Галогенирование. Такая реакция является цепной. При ней молекула брома или йода подвергается воздействию света и распадается на радикалы, которое затем атакуют молекулы метана. В результате от соединения отрывается атом водорода, а газ становится свободным метилом Ch4. Получившееся вещество сталкивается с молекулами брома или йода, которые разрушаются, образуя новые радикалы этих реагентов.
- Нитрование.
- Окисление или горение. Эта реакция происходит при избытке кислорода и описывается следующим уравнением: Ch5 + 2O2 → CO2 + 2h3O. В этом случае пламя имеет голубой цвет. Если кислорода недостаточно, то результатом реакции становится выработка не углекислого газа, а оксида углерода. Если же кислорода ещё меньше, то взаимодействие веществ приведёт к выделению мелкодисперсного углерода.
- Сульфохлорирование.
- Сульфоокисление.
- Разложение.
- Дегидрирование.
- Каталитическое окисление. В подобных реакциях из болотного газа образуются карбоновые кислоты, спирты, альдегиды.
Получение в промышленности и лаборатории
В промышленных условиях вещество получают посредством нагревания углерода и водорода или синтеза водяного газа. Для того чтобы реакция протекала успешно, используют катализатор, обычно в этом качестве применяется никель. В США для добычи простейшего углеводорода используется специальная система, способная извлекать соединение из природного угля. Но также метан выделяется в виде подобного продукта при термической переработке нефти и нефтепродуктов, коксовании и гидрировании каменного угля.
В лаборатории для получения вещества применяются следующие методы:
- Реакция гидроксида натрия с ацетатом натрия.
- Взаимодействие карбида алюминия.
- Нагревание натристой извести с уксусной кислотой. Для этой реакции необходима безводная среда, а потому в ней применяется гидроксид натрия, который является наименее гигроскопичным.
Болотный газ самый термически устойчивый углеводород, а потому он широко применяется и в быту, и в промышленности. Хлорирование вещества даёт возможность получения метилхлорида, метиленхлорида, хлороформа, четырёххлористого углерода. Результатом его неполного сгорания является сажа, Если метан каталитически окисляется, то получается формальдегид. А его реакция с серой приводит к образованию сероуглерода.
К важным методам получения ацетилена из простейшего углеводорода относятся:
- термоокислительный крекинг,
- электрокрекинг.
Газ также применяется для производства синильной кислоты. Кроме того, он даёт водород, необходимый для выработки водяного газа, который, в свою очередь, применяется для создания углеводородов, альдегидов и тому подобного. Кроме того, метан необходим при производстве нитрометана.
В настоящее время газ стал часто использоваться в качестве автомобильного топлива. Но его плотность в 1000 раз меньше плотности бензина, а потому, чтобы заправить автомобиль метаном на тот же объём, что и бензином, при равном давлении необходим соответствующий бак. В таком случае для обычной поездки потребовалось бы возить прицеп с топливом.
Учёные решили эту проблему, увеличив плотность газа до 200−250 атмосфер. Сжатое вещество закачивается в специальные баллоны, установленные на автомобилях особой конструкции.
Парниковый эффект

Метан является одним из газов, создающих на планете парниковый эффект. Чтобы измерить уровень его парниковой активности, необходимо принять за единицу меру воздействия на климат нашей планеты диоксида углерода. При таком соотношении влияние метана будет равно 23. Специалисты в области изучения парникового эффекта отмечают, что количество указанного газа в земной атмосфере значительно выросло за последние два столетия.
Объём метана в современной атмосфере в среднем составляет 1,8 части на миллион. Это количество в 200 раз меньше того же показателя углекислого газа. Необходимо отметить, что молекулы соединения рассеивают и удерживают теплоту, которую излучает нагретая солнцем планета, гораздо лучше, чем молекулы углекислого газа. И также необходимо отметить, что углеводород поглощает земное излучение в тех спектральных областях, которые свободно проходят через другие газовые соединения, создающие эффект парника.
Но тем не менее такие газы планете необходимы. Без двуокиси углерода, водяных паров, метана и других составляющих атмосферы температура на поверхности Земли была бы значительно ниже средних 15 градусов тепла.
Влияние на организм человека

Человек может отравиться, надышавшись метаном при аварии на производстве или из-за неправильного обращения с приборами, работающими на этом газе. Возможна такая ситуация и при длительном нахождении на болоте, в шахте. Если концентрация вещества в воздухе составляет 20 и более процентов, то отравление может быть очень тяжёлым, вплоть до летального исхода.
Работники химических производств, рудников и шахт подвержены другому способу отравления углеводородом. Зачастую эти люди на протяжении длительного времени регулярно вдыхают небольшие дозы вещества.
Кроме того, хроническая интоксикация может наступить из-за заболеваний кишечника, например, дисбактериоза. В таких случаях в организме больного метан образуется в повышенном количестве. Этот газ не станет причиной серьёзной интоксикации, но всё же он может вызвать в организме разные нарушения, привести к желудочно-кишечному дискомфорту и общему ухудшению самочувствия.
Отличить острое отравление метаном можно по следующим признакам:


- головокружение;
- шум в ушах;
- сонливость;
- общая слабость;
- потеря координации;
- нарушение речи;
- резь в глазах;
- слезотечение;
- удушье;
- усиленное сердцебиение;
- понижение артериального давления;
- тошнота;
- приступы рвоты;
- синюшность кожных покровов и слизистых оболочек.
Если отравление тяжёлое, то человек теряет сознание, у него начинаются судороги, за которыми следует кома. А также возможна остановка дыхания и сердцебиения.

Если отравление метаном является хроническим, то пострадавший страдает от частых головных болей, общего недомогания, низкого артериального давления и снижения работоспособности. Человек становится бледным и вялым, испытывает упадок сил. Гипотония может вызывать обмороки. И также возможно истощение нервной системы, которое выражается в повышенной раздражительности, нервозности и тому подобном.
Метан известен, как один из самых опасных газов. Он токсичен, горюч и взрывоопасен. Вещество не имеет ни цвета, ни запаха, а потому обнаружить его в воздухе крайне сложно. Чтобы не подвергать своё здоровье и жизнь опасности, следует внимательно относится к технике безопасности и соблюдать осторожность при работе или бытовом использовании метана.
Свойства метана
Метан горит в воздухе голубоватым пламенем, при этом выделяется энергия около 39 МДж на 1м3. С воздухом образует взрывоопасные смеси. Особую опасность представляет метан, выделяющийся при подземной разработке месторождений полезных ископаемых в горные выработки, а также на угольных обогатительных и брикетных фабриках, на сортировочных установках. Так, при содержании в воздухе до 5–6% метан горит около источника тепла (температура воспламенения 650—750 °С), от 5–6% до 14–16% взрывается, свыше 16% может гореть при притоке кислорода извне. Снижение при этом концентрации метана может привести к взрыву. Кроме того, значительное увеличение концентрации метана в воздухе бывает причиной удушья (например, концентрации метана 43% соответствует 12% O2).
Взрывное горение распространяется со скоростью 500—700 м/сек; давление газа при взрыве в замкнутом объёме равно 1 Мн/м2. После контакта с источником тепла воспламенение метана происходит с некоторым запаздыванием. На этом свойстве основано создание предохранительных взрывчатых веществ и взрывобезопасного электрооборудования. На объектах, опасных из-за присутствия метана (главным образом, угольные шахты), вводится т.н. газовый режим.
При 150-200 °С и давлении 30-90 атм метан окисляется до муравьиной кислоты.
Метан образует соединения включения — газовые гидраты, широко распространенные в природе.
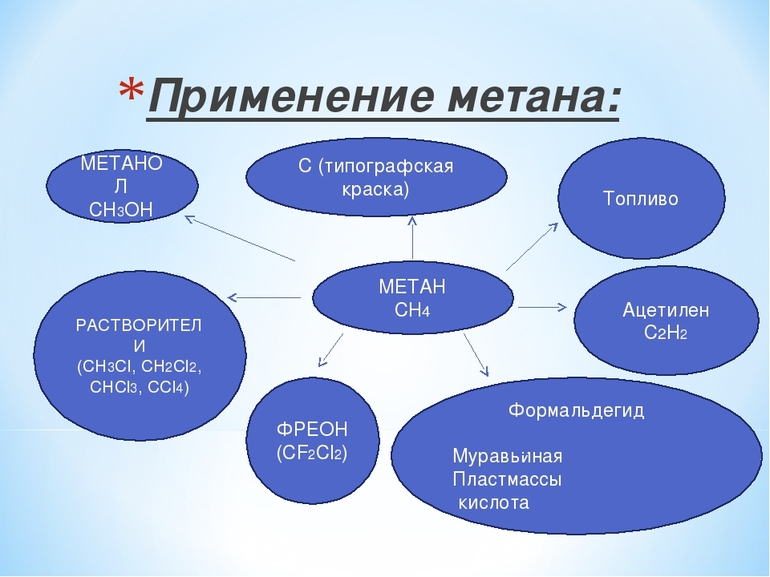
Применение метана
Метан — наиболее термически устойчивый насыщенный углеводород. Его широко используют как бытовое и промышленное топливо и как сырьё для промышленности. Так, хлорированием метана производят метилхлорид, метиленхлорид, хлороформ, четырёххлористый углерод.
При неполном сгорании метана получают сажу, при каталитическом окислении — формальдегид, при взаимодействии с серой — сероуглерод.
Термоокислительный крекинг и электрокрекинг метана— важные промышленные методы получения ацетилена.
Каталитическое окисление смеси метана с аммиаком лежит в основе промышленного производства синильной кислоты. Метан используют как источник водорода в производстве аммиака, а также для получения водяного газа (т. н. синтез-газа): CH4 + H2O → CO + 3H2, применяемого для промышленного синтеза углеводородов, спиртов, альдегидов и др. Важное производное метана — нитрометан.
Метан и парниковый эффект
Метан является парниковым газом. Если степень воздействия углекислого газа на климат условно принять за единицу, то парниковая активность метана составит 23 единицы. Содержание в атмосфере метана росло очень быстро на протяжении последних двух столетий.
Сейчас среднее содержание метана CH4 в современной атмосфере оценивается как 1,8 ppm (parts per million, частей на миллион). И, хотя это в 200 раз меньше, чем содержание в ней углекислого газа (CO2), в расчете на одну молекулу газа парниковый эффект от метана — то есть его вклад в рассеивание и удержание тепла, излучаемого нагретой солнцем Землей — существенно выше, чем от СО2. Кроме того, метан поглощает излучение Земли в тех «окошках» спектра, которые оказываются прозрачными для других парниковых газов. Без парниковых газов — СO2, паров воды, метана и некоторых других примесей средняя температура на поверхности Земли была бы всего –23°C , а сейчас она около +15°C.
Метан высачивается на дне океана через трещины земной коры, выделяется в немалом количестве при горных разработках и при сжигании лесов. Недавно обнаружен новый, совершенно неожиданный источник метана — высшие растения, но механизмы образования и значение данного процесса для самих растений пока не выяснены.
Где используют метан? | Kratkoe.com


Краткая характеристика метана и где его используют, Вы узнаете из этой статьи.
Что такое метан?
Метан – это газ, который имеет органическую природу, без выраженного запаха и цвета с массой меньшей, чем у воздуха. В воде растворяется достаточно медленно.
Где используется метан?
* На метане зачастую функционируют двигатели внутреннего сгорания.
* Метан дает возможность изготавливать большое количество медикаментов, среди которых снотворные и препараты антисептики.
* Метан является основой для метанола и формальдегида, из которых потом производятся удобрения.
* Без этого элемента невозможно изготовить растворители, а также огнетушители.
* На основе окисления метана и аммиака изготавливают синильную кислоту.
* В процессе сгорания газа получают сажу, а в процессе каталитического окисления — формальдегид, в процессе взаимодействия метана с серой получается сероуглерод.
* Из метана получают ацетилен.
Естественные источники метана:
- Фермерский скот. Бактерии, которые обитают в их желудках, способны выделять метан в ходе жизнедеятельности животных. На его долю полагается около 20% общего атмосферного газа.
- Растения. Метан выделяется в процессе фотосинтеза растений.
- Насекомые. Наиболее активными в этом плане являются термиты.
- Шахты. Под поверхностью земли происходит постоянное, медленное разложение такой породы как каменный уголь, после чего выделяется метан.
- Нефтяные скважины. Метана в нефти содержится очень большое количество.
- Вулканы. Метан выделяется в процессе активного разложения доисторических органических материй.
- Океан. Глубоко под толщей воды есть трещины, из которые сочится метан.
- Горение лесов.
- Промышленность. На ее долю припадает малая часть по выделению метана.
Надеемся, что из этой статьи Вы узнали где используется метан и какие источники метана.
Биогаз — Википедия
 Метантанк биогазовой установки
Метантанк биогазовой установкиБиогаз — газ, получаемый водородным или метановым брожением биомассы. Метановое разложение биомассы происходит под воздействием трёх видов бактерий. В цепочке питания последующие бактерии питаются продуктами жизнедеятельности предыдущих. Первый вид — бактерии гидролизные, второй — кислотообразующие, третий — метанообразующие. В производстве биогаза участвуют не только бактерии класса метаногенов, а все три вида. Одной из разновидностей биогаза является биоводород, где конечным продуктом жизнедеятельности бактерий является не метан, а водород.
История
В XVII веке Ян Баптист Ван Гельмонт обнаружил, что разлагающаяся биомасса выделяет воспламеняющиеся газы. Алессандро Вольта в 1776 году пришёл к выводу о существовании зависимости между количеством разлагающейся биомассы и количеством выделяемого газа. В 1808 году сэр Хэмфри Дэви обнаружил метан в биогазе.
Первая задокументированная биогазовая установка была построена в Бомбее, Индия в 1859 году. В 1895 году биогаз применялся в Великобритании для уличного освещения. В 1930 году, с развитием микробиологии, были обнаружены бактерии, участвующие в процессе производства биогаза.
В СССР исследования проводились в 40-х годах прошлого века. В 1948—1954 гг. была разработана и построена первая лабораторная установка. В 1981 году при Госкомитете по науке и технике была создана специализированная секция по программе развития биогазовой отрасли. Запорожский конструкторско-технологический институт сельскохозяйственного машиностроения построил 10 комплектов оборудования[1].
Состав и качество биогаза
50—87 % метана, 13—50 % CO2, незначительные примеси H2 и H2S. После очистки биогаза от СО2 получается биометан. Биометан — полный аналог природного газа, отличие только в происхождении.
Поскольку только метан поставляет энергию из биогаза, целесообразно, для описания качества газа, выхода газа и количества газа все относить к метану, с его нормируемыми показателями. Объём газов зависит от температуры и давления. Высокие температуры приводят к расширению газа и к уменьшаемому вместе с объёмом уровню калорийности и наоборот. Кроме того при возрастании влажности калорийность газа также снижается. Чтобы выходы газа можно было сравнить между собой, необходимо их соотносить с нормальным состоянием (температура 0 °C, атмосферное давление 1,01325 bar, относительная влажность газа 0%). В целом данные о производстве газа выражают в литрах (л) или кубических метрах (м³) метана на 1 кг органического сухого вещества (ОСВ), это намного точнее и красноречивее, нежели данные в м³ биогаза в м³ свежего субстрата.
Сырьё для получения
Перечень органических отходов, пригодных для производства биогаза: навоз, птичий помёт, зерновая и мелассная послеспиртовая барда, пивная дробина, свекольный жом, фекальные осадки, отходы рыбного и забойного цеха (кровь, жир, кишки, каныга), трава, бытовые отходы, отходы молокозаводов — соленая и сладкая молочная сыворотка, отходы производства биодизеля — технический глицерин от производства биодизеля из рапса, отходы от производства соков — жом фруктовый, ягодный, овощной, виноградная выжимка, водоросли, отходы производства крахмала и патоки — мезга и сироп, отходы переработки картофеля, производства чипсов — очистки, шкурки, гнилые клубни, кофейная пульпа.
Кроме отходов биогаз можно производить из специально выращенных энергетических культур, например, из силосной кукурузы или сильфия, а также водорослей. Выход газа может достигать до 300 м³ из 1 тонны.
Выход биогаза зависит от содержания сухого вещества и вида используемого сырья. Из тонны навоза крупного рогатого скота получается 50—65 м³ биогаза с содержанием метана 60 %, 150—500 м³ биогаза из различных видов растений с содержанием метана до 70 %. Максимальное количество биогаза — это 1300 м³ с содержанием метана до 87 % — можно получить из жира.
Различают теоретический (физически возможный) и технически-реализуемый выход газа. В 1950-70-х годах технически возможный выход газа составлял всего 20-30 % от теоретического. Сегодня применение энзимов, бустеров для искусственной деградации сырья (например, ультразвуковых или жидкостных кавитаторов) и других приспособлений позволяет увеличивать выход биогаза на самой обычной установке с 60 % до 95 %.
В биогазовых расчётах используется понятие сухого вещества (СВ или английское TS) или сухого остатка (СО). Вода, содержащаяся в биомассе, не даёт газа.
На практике из 1 кг сухого вещества получают от 300 до 500 литров биогаза.
Чтобы посчитать выход биогаза из конкретного сырья, необходимо провести лабораторные испытания или посмотреть справочные данные и определить содержание жиров, белков и углеводов. При определении последних важно узнать процентное содержание быстроразлагаемых (фруктоза, сахар, сахароза, крахмал) и трудноразлагаемых веществ (например, целлюлоза, гемицеллюлоза, лигнин). Определив содержание веществ, можно вычислить выход газа для каждого вещества по отдельности и затем сложить.
Раньше, когда не было науки о биогазе и биогаз ассоциировался с навозом, применяли понятие «животной единицы». Сегодня, когда биогаз научились получать из произвольного органического сырья, это понятие отошло и перестало использоваться.
Свалочный газ — одна из разновидностей биогаза. Получается на свалках из муниципальных бытовых отходов.
Экология
Производство биогаза позволяет предотвратить выбросы метана в атмосферу. Метан оказывает влияние на парниковый эффект в 21 раз более сильное, чем СО2, и находится в атмосфере 12 лет. Захват метана — лучший краткосрочный способ предотвращения глобального потепления.
Переработанный навоз, барда и другие отходы применяются в качестве удобрения в сельском хозяйстве. Это позволяет снизить применение химических удобрений, сокращается нагрузка на грунтовые воды.
Производство
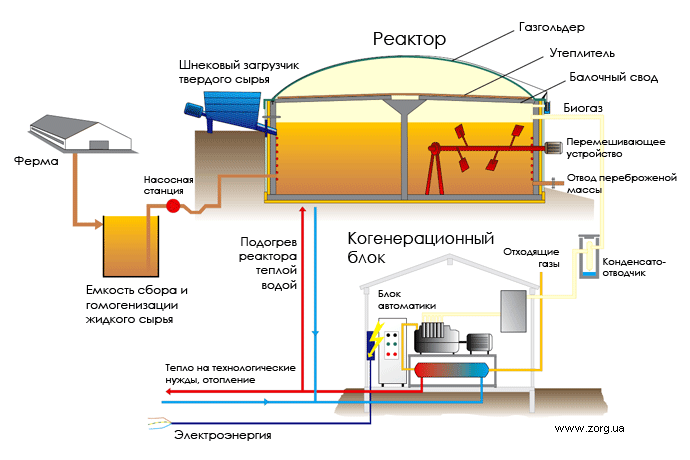
Существуют промышленные и кустарные установки. Промышленные установки отличаются от кустарных наличием механизации, систем подогрева, гомогенизации, автоматики. Наиболее распространённый промышленный метод — анаэробное сбраживание в метантанках.
Хорошая биогазовая установка должна иметь необходимые части:
- Ёмкость гомогенизации
- Загрузчик твердого (жидкого) сырья
- Реактор
- Мешалки
- Газгольдер
- Система смешивания воды и отопления
- Газовая система
- Насосная станция
- Сепаратор
- Приборы контроля
- КИПиА с визуализацией
- Система безопасности
Принцип работы установки
Биомасса (отходы или зелёная масса) периодически подаются с помощью насосной станции или загрузчика в реактор. Реактор представляет собой подогреваемый и утепленный резервуар, оборудованный миксерами. Стройматериалом для промышленного резервуара чаще всего служит железобетон или сталь с покрытием. В малых установках иногда используются композиционные материалы. В реакторе живут полезные бактерии, питающиеся биомассой. Продуктом жизнедеятельности бактерий является биогаз. Для поддержания жизни бактерий требуется подача корма, подогрев до 35-38 °С и периодическое перемешивание. Образующийся биогаз скапливается в хранилище (газгольдере), затем проходит систему очистки и подается к потребителям (котел или электрогенератор). Реактор работает без доступа воздуха, герметичен и неопасен.
Для сбраживания некоторых видов сырья в чистом виде требуется особая технология. Например, спиртовая барда перерабатываются с использованием химических добавок. Для кислой меласной барды используется щелочь. Возможна переработка этих же субстратов по одностадийной технологии без химических добавок, но при коферментации (смешивании) с другими видами сырья, например, с навозом или силосом.
Факторы, влияющие на процесс брожения
- Температура
- Влажность среды
- Уровень рН
- Соотношение C : N : P
- Площадь поверхности частиц сырья
- Частота подачи субстрата
- Замедляющие вещества
- Стимулирующие добавки
Температура
Метановые бактерии проявляют свою жизнедеятельность в пределах температуры 0-70ºС. Если температура выше они начинают гибнуть, за исключением нескольких штаммов, которые могут жить при температуре среды до 90ºС. При минусовой температуре они выживают, но прекращают свою жизнедеятельность. В литературе как нижнюю границу температуры указывают 3-4ºС.
Площадь поверхности частиц сырья
Принципиальным является, что чем меньше частички субстрата, тем лучше. Чем больше площадь взаимодействия для бактерий и чем более волокнистый субстрат, тем легче и быстрее бактериям разлагать субстрат. Кроме того, его проще перемешивать, смешивать и подогревать без образования плавающей корки или осадка. Измельченное сырье имеет влияние на количество произведенного газа через длительность периода брожения. Чем короче период брожения, тем лучше должен быть измельчен материал.
При достаточно длительном периоде брожения количество выработанного газа снова увеличится. При использовании измельченного зерна этого уже удалось достичь через 15 дней.
Применение

Биогаз используют в качестве топлива для производства: электроэнергии, тепла или пара, или в качестве автомобильного топлива.
Биогазовые установки могут устанавливаться как очистные сооружения на фермах, птицефабриках, спиртовых заводах, сахарных заводах, мясокомбинатах. Биогазовая установка может заменить ветеринарно-санитарный завод, т. е. падаль может утилизироваться в биогаз вместо производства мясо-костной муки.
Среди промышленно развитых стран ведущее место в производстве и использовании биогаза по относительным показателям принадлежит Дании — биогаз занимает до 18 % в её общем энергобалансе. По абсолютным показателям по количеству средних и крупных установок ведущее место занимает Германия — 8000 установок. В Западной Европе не менее половины всех птицеферм отапливаются биогазом.
Развивающиеся страны
В Индии, Вьетнаме, Непале и других странах строят малые (односемейные) биогазовые установки. Получаемый в них газ используется для приготовления пищи.
Больше всего малых биогазовых установок находится в Китае — более 10 млн (на конец 1990-х). Они производят около 7 млрд м³ биогаза в год, что обеспечивает топливом примерно 60 млн крестьян. В конце 2010 года в Китае действовало уже около 40 млн биогазовых установок. В биогазовой индустрии Китая заняты 60 тысяч человек[2].
В Индии с 1981 года до 2006 года было установлено 3,8 млн малых биогазовых установок.
В Непале существует программа поддержки развития биогазовой энергетики, благодаря которой в сельской местности к концу 2009 года было создано 200 тысяч малых биогазовых установок[3].
Автомобильный транспорт
Volvo и Scania производят автобусы с двигателями, работающими на биогазе. Такие автобусы активно используются в городах Швейцарии: Берн, Базель, Женева, Люцерн и Лозанна. По прогнозам Швейцарской Ассоциации Газовой Индустрии к 2010 году 10 % автотранспорта Швейцарии будет работать на биогазе.
Муниципалитет Осло в начале 2009 года перевёл на биогаз 80 городских автобусов. Стоимость биогаза составляет €0,4 — €0,5 за литр в бензиновом эквиваленте. При успешном завершении испытаний на биогаз будут переведены 400 автобусов[4].
Потенциал
В России агрокомплекс ежегодно производит 773 миллиона тонн отходов, из которых можно получить 66 миллиардов м3 биогаза, или около 110 миллиардов кВт•ч электроэнергии. Общая потребность России в биогазовых заводах оценивается в 20 тысяч предприятий[5].
В США выращивается около 8,5 миллионов коров. Биогаза, получаемого из их навоза, будет достаточно для обеспечения топливом 1 миллиона автомобилей[6].
Потенциал биогазовой индустрии Германии оценивается в 100 миллиардов кВт·ч энергии к 2030 году, что будет составлять около 10% от потребляемой страной энергии.
Критика
Использование для производства биогаза энергетических культур подвергается критике со стороны зеленых, в частности в Германии. К отрицательным сторонам среди прочего они относят:
См. также
Примечания
Литература
Ссылки
Метан
TR | UK | KK | BE | EN |метандиенон, метан станции в българия
Мета́н (лат. Methanum) — простейший углеводород, бесцветный газ (в нормальных условиях) без запаха, химическая формула — Ch5. Малорастворим в воде, легче воздуха. При использовании в быту, промышленности в метан обычно добавляют одоранты (обычно тиолы) со специфическим «запахом газа». Метан нетоксичен и неопасен для здоровья человека.
Однако имеются данные, что метан относится к токсическим веществам, действующим на центральную нервную систему.
Накапливаясь в закрытом помещении, метан взрывоопасен. Обогащение одорантами делается для того, чтобы человек вовремя заметил утечку газа. На промышленных производствах эту роль выполняют датчики, и во многих случаях метан для лабораторий и промышленных производств остаётся без запаха.
Метан — первый член гомологического ряда насыщенных углеводородов (алканов), наиболее устойчив к химическим воздействиям. Подобно другим алканам вступает в реакции радикального замещения (галогенирования, сульфохлорирования, сульфоокисления, нитрования и др.), но обладает меньшей реакционной способностью. Специфична для метана реакция с парами воды, которая протекает на Ni/Al2O3 при 800—900 °C или без катализатора при 1400—1600 °C; образующийся синтез-газ может быть использован для синтеза метанола, углеводородов, уксусной кислоты, ацетальдегида и других продуктов.
Взрывоопасен при концентрации в воздухе от 4,4 % до 17 %. Наиболее взрывоопасная концентрация 9,5 %. Является наркотиком; действие ослабляется ничтожной растворимостью в воде и крови. Класс опасности — четвёртый.
Сэр Гемфри Дэви (учёный-химик) ещё в 1813 г. заключил из своих анализов, что рудничный газ есть смесь метана Ch5 с небольшим количеством азота N2 и угольного ангидрида СО2 — т.е., что он качественно тождественен по составу с газом, выделяющимся из болот.
Содержание
- 1 Нахождение в природе
- 2 В промышленности
- 3 Классификация по происхождению
- 4 Получение
- 5 Химические свойства
- 6 Соединения включения
- 7 Применение метана
- 8 Физиологическое действие
- 8.1 Хроническое действие метана
- 9 Биологическая роль
- 10 Метан и экология
- 11 Ссылки
- 12 Примечания
- 13 Литература
Нахождение в природе
Основной компонент природного газа (77—99 %), попутных нефтяных газов (31—90 %), рудничного и болотного газов (отсюда произошли другие названия метана — болотный или рудничный газ). В анаэробных условиях (в болотах, переувлажнённых почвах, кишечнике жвачных животных) образуется биогенно в результате жизнедеятельности некоторых микроорганизмов.
По современным данным, в атмосферах планет-гигантов солнечной системы в заметных концентрациях содержится метан.
Предположительно, на поверхности Титана в условиях низких температур (−180 °C) существуют целые озёра и реки из жидкой метано-этановой смеси. Велика доля метановых льдов и на поверхности Седны.
В промышленности
Образуется при коксовании каменного угля, гидрировании угля, гидрогенолизе углеводородов в реакциях каталитического риформинга.
Классификация по происхождению
- абиогенный — образован в результате химических реакций неорганических соединений, например, при взаимодействии карбидов металлов с водой;
- биогенный — образован как результат химической трансформации органического вещества;
- бактериальный (микробный) — образован в результате жизнедеятельности бактерий;
- термогенный — образован в ходе термохимических процессов.
Получение
В лаборатории получают нагреванием натронной извести (смесь гидроксидов натрия и кальция) или безводного гидроксида натрия с ледяной уксусной кислотой.
Для этой реакции важно отсутствие воды, поэтому и используется гидроксид натрия, так как он менее гигроскопичен.
Возможно получение метана сплавлением ацетата натрия с гидроксидом натрия:
Также для лабораторного получения метана используют гидролиз карбида алюминия или некоторых металлорганических соединений (например, метилмагнийбромида).
Химические свойства
Горит в воздухе голубоватым пламенем, при этом выделяется энергия около 33,066 МДж на 1 м³. С воздухом образует взрывоопасные смеси при объёмных концентрациях от 4,4 % до 17 %. Точка замерзания −184oС (при нормальном давлении)
Вступает с галогенами в реакции замещения, которые проходят по свободно-радикальному механизму:
Выше 1400 °C разлагается по реакции:
Реакция горения метана:
Окисляется до муравьиной кислоты при 150—200 °C и давлении 30—90 атм. по цепному радикальному механизму:
Соединения включения
Метан образует соединения включения — газовые гидраты, широко распространенные в природе.
Применение метана
- Топливо.
- Сырьё в органическом синтезе.
Физиологическое действие
Метан является самым физиологически безвредным газом в гомологическом ряду парафиновых углеводородов. Физиологическое действие метан не оказывает и не ядовит (из-за малой растворимости метана в воде и плазме крови и присущей парафинам химической инертности). Погибнуть человеку в воздухе, с высокой концентрацией метана можно только от недостатка кислорода в воздухе для дыхания при очень высоких концентрациях метана. Так, при содержании в воздухе 25—30 % метана появляются первые признаки асфиксии (учащение пульса, увеличение объёма дыхания, нарушение координации тонких мышечных движений и т. д.). Более высокие концентрации метана в воздухе вызывают у человека кислородное голодание — головную боль, одышку, — симптомы, характерные для горной болезни.
Так как метан легче воздуха, он не скап
Этан — Википедия
| Этан | |||
|---|---|---|---|
 ( ({{{картинка малая}}}) | |||
| Систематическое наименование | Этан | ||
| Хим. формула | C2H6 | ||
| Рац. формула | H3CCH3 | ||
| Состояние | газ | ||
| Молярная масса | 30,07 г/моль | ||
| Плотность | 1,2601 кг/м³ в стандартных условиях по ГОСТ 2939—63; при н. у. (0С) 0,001342 г/см³ | ||
| Температура | |||
| • плавления | −182,8 °C | ||
| • кипения | −88,6 °C | ||
| • вспышки | 152 °C | ||
| • воспламенения | 152 °C | ||
| • самовоспламенения | 472 °C | ||
| Мол. теплоёмк. | 52,65 Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | -84,67 кДж/моль | ||
| Давление пара | 2,379 МПа (0°С) | ||
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 42 (вода, 20°С) | ||
| Рег. номер CAS | 74-84-0 | ||
| PubChem | 6324 | ||
| Рег. номер EINECS | 200-814-8 | ||
| SMILES | |||
| InChI | |||
| RTECS | Kh4800000 | ||
| ChEBI | 42266 | ||
| Номер ООН | 1035 | ||
| ChemSpider | 6084 | ||
| Токсичность | Малотоксичен. Обладает слабым наркотическим действием | ||
| Краткие характер. опасности (H) | |||
| Меры предостор. (P) | P210, P377, P381, P410+P403 | ||
| Сигнальное слово | Опасно | ||
| Пиктограммы СГС |   | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
Эта́н (лат. ethanum), C2H6 — органическое соединение, второй член гомологического ряда алканов. Газ без цвета и запаха. В промышленности этан получают из природного газа и нефти и расходуют преимущественно для производства этилена.
Этан при н. у. — бесцветный газ, без запаха и вкуса. Молярная масса — 30,07. Температура плавления −183,23 °C, температура кипения −88,63 °C. Плотность ρгаз.=0,001342 г/см³ или 1,342 кг/м³ (н. у.), ρжидк.=0,561 г/см³ (T=-100 °C). Давление паров при 0 °C — 2,379 МПа. Растворимость в воде — 4,7 мл в 100 мл (при 20 °C), в этаноле — 46 мл в 100 мл (при 0 °C), хорошо растворяется в углеводородах. Точка вспышки у этана равна –187,8 °C, температура самовоспламенения — 595 °C. Этан образует с воздухом взрывоопасные смеси при содержании 5–15 об. % (при 20 °C). Октановое число —120,3[2][3][4].
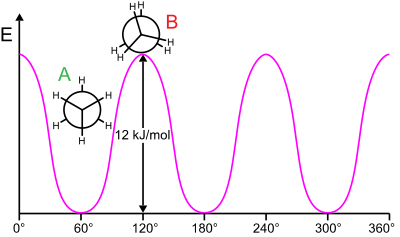
 Параметры молекулы этана
Конформеры этана
Параметры молекулы этана
Конформеры этанаМолекула этана имеет тетраэдрическое строение: атомы углерода являются sp3-гибридными. Связь C–C образована перекрыванием sp3-гибридных орбиталей, а связь C–H — перекрыванием sp3-гибридной орбитали углерода и s-орбитали водорода. Длина связи C–C равна 1,54 Å, а длина связи C–H равна 1,095 Å[5].
Поскольку С–С-связь в этане одинарная, вокруг неё возможно свободное вращение метильных групп. При вращении возникают различные пространственные формы молекулы этана, которые называются конформациями. Конформации принято изображать в виде перспективного изображения (такие изображения иногда называют «лесопильными козлами») либо в виде проекций Ньюмена[5].
Число конформаций для этана бесконечно, однако принято рассматривать две крайние конформации:
- заслонённую, в которой атомы водорода максимально сближены в пространстве;
- и заторможенную, в которой атомы водорода максимально удалены[5].
Заслонённая конформация имеет наибольшую энергию из всех конформаций, а заторможенная — наименьшую, то есть является наиболее энергетически выгодной и, следовательно, более устойчивой. Разница энергии между этими конформациями равна 2,9 ккал/моль. Считается, что это число отражает торсионное напряжение в менее выгодной заслонённой конформации. Если разделить эту энергию на три взаимодействия между парами атомов водорода, то энергия торсионного взаимодействия двух атомов водорода составит примерно 1 ккал/моль[5].
По значению 2,9 ккал/моль из уравнения Гиббса можно вычислить константу равновесия между двумя конформациями этана. При температуре 25 °С значительно преобладает заторможенная конформация: 99 % молекул этана находятся в этой конформации и лишь 1 % — в заслонённой[5].
Энергии крайних и промежуточных конформаций принято представлять в виде циклических графиков, где по оси абсцисс отложен торсионный угол, а по оси ординат — энергия.
В промышленности[править | править код]
В промышленности получают из нефтяных и природных газов, где он составляет до 10 % по объёму. В России содержание этана в нефтяных газах очень низкое. В США и Канаде (где его содержание в нефтяных и природных газах высоко) служит основным сырьём для получения этилена[6]. Также этан получают при гидрокрекинге углеводородов и ожижении углей[7].
В лабораторных условиях[править | править код]
В 1848 году Кольбе и Франкленд впервые синтетически получили этан, обработав пропионитрил металлическим калием. В 1849 году они получили этот газ электролизом ацетата калия и действием цинка и воды на иодэтан[8].
В лаборатории этан можно получить несколькими способами:
- 2Ch4I+2Na→Ch4Ch4+2NaI{\displaystyle {\mathsf {2CH_{3}I+2Na\rightarrow CH_{3}CH_{3}+2NaI}}}
- Ch4COO−−e−→Ch4COO⋅→Ch4⋅+CO2{\displaystyle {\mathsf {CH_{3}COO^{-}-e^{-}\rightarrow CH_{3}COO\cdot \rightarrow CH_{3}\cdot +CO_{2}}}}
- 2Ch4⋅→Ch4Ch4{\displaystyle {\mathsf {2CH_{3}\cdot \rightarrow CH_{3}CH_{3}}}}
- Ch4Ch3COONa+NaOH→Ch4Ch4+Na2CO3{\displaystyle {\mathsf {CH_{3}CH_{2}COONa+NaOH\rightarrow CH_{3}CH_{3}+Na_{2}CO_{3}}}}
- Ch4Ch3Br+Mg→Ch4Ch3MgBr{\displaystyle {\mathsf {CH_{3}CH_{2}Br+Mg\rightarrow CH_{3}CH_{2}MgBr}}}
- Ch4Ch3MgBr+h3O→Ch4Ch4+MgOHBr{\displaystyle {\mathsf {CH_{3}CH_{2}MgBr+H_{2}O\rightarrow CH_{3}CH_{3}+MgOHBr}}}
- Ch3Ch3+h3→Ch4Ch4{\displaystyle {\mathsf {CH_{2}CH_{2}+H_{2}\rightarrow CH_{3}CH_{3}}}}
- HC≡CH+2h3→Ch4Ch4{\displaystyle {\mathsf {HC\equiv CH+2H_{2}\rightarrow CH_{3}CH_{3}}}}
Этан вступает в типичные реакции алканов, прежде всего реакции замещения, проходящие по свободнорадикальному механизму. Среди химических свойства этана можно выделить:
Основное использование этана в промышленности — получение этилена методом парового крекинга. Именно из этилена далее получают важные промышленные продукты, однако в целях экономии разрабатываются методы превращения в них самого этана. Однако ни один из проектов пока не прошёл пилотную стадию. Проблемы в этой области связаны с низкой селективностью реакций. Одним из перспективных направлений является синтез винилхлорида напрямую из этана. Также применяется превращение этана в уксусную кислоту. Термическим хлорированием этана в различных условиях получают хлорэтан, 1,1-дихлорэтан и 1,1,1-трихлорэтан[7].
Этан обладает слабым наркотическим действием (ослаблено за счёт низкой растворимости в жидкостях организма). Класс опасности — четвёртый[9]. В концентрациях 2-5 об. % он вызывает одышку, в умеренных концентрациях — головные боли, сонливость, головокружение, повышенное слюноотделение, рвоту и потерю сознания из-за недостатка кислорода. В высоких концентрациях этан может вызвать сердечную аритмию, остановку сердца и остановку дыхания. При постоянном контакте может возникнуть дерматит. Сообщается, что при 15-19 об. % этан вызывает повышение чувствительности миокарда к катехоламинам[10].
Предположительно, на поверхности Титана (спутник Сатурна) в условиях низких температур (−180 °C) существуют целые озёра и реки из жидкой метано-этановой смеси[11].
- ↑ Ethane (неопр.). Sigma-Aldrich. Дата обращения 6 апреля 2019.
- ↑ Ullmann, 2014, p. 3–5.
- ↑ 1 2 3 Химическая энциклопедия.
- ↑ Рабинович В. А., Хавин З. Я. Краткий химический справочник. — Изд. 2-е. — Химия, 1978. — С. 199.
- ↑ 1 2 3 4 5 Реутов О. А., Курц А. Л., Бутин К. П. Органическая химия : в 4 т.. — 5-е изд. — БИНОМ. Лаборатория знаний, 2014. — Т. 1. — С. 321—326. — ISBN 978-5-9963-1535-2.
- ↑ Химическая энциклопедия, 1998.
- ↑ 1 2 Ullmann, 2014, p. 13.
- ↑ ЭСБЕ.
- ↑ Газохроматографическое измерение массовых концентраций углеводородов: метана, этана, этилена, пропана, пропилена, нбутана, альфа-бутилена, изопентана в воздухе рабочей зоны. Методические указания. МУК 4.1.1306-03
- ↑ Ullmann, 2014, p. 61.
- ↑ Mousis O., Schmitt B. Sequestration of Ethane in the Cryovolcanic Subsurface of Titan (англ.) // The Astrophysical Journal : journal. — IOP Publishing, 2008. — April (vol. 677). — DOI:10.1086/587141.
- Братков А. А. Этан // Химическая энциклопедия: в 5 т. / Н. С. Зефиров (гл. ред.). — М.: Большая Российская энциклопедия, 1998. — Т. 5: Триптофан—Ятрохимия. — С. 491. — 783 с. — 10 000 экз. — ISBN 5-85270-310-9.
- Schmidt R., Griesbaum K., Behr A., Biedenkapp D., Voges H.-W., Garbe D., Paetz C., Collin G., Mayer D., Höke H. Hydrocarbons (англ.) // Ullmann’s Encyclopedia of Industrial Chemistry. — Wiley, 2014. — DOI:10.1002/14356007.a13_227.pub3.
- The chemistry of alkanes and cycloalkanes / Ed. Saul Patai and Zvi Rappoport. — John Wiley & Sons, 1992. — ISBN 0-471-92498-9.
- Тутурин Н. Н. Этан // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
 (
(