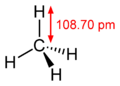Гидрат метана — Википедия
 Горение гидрата метана
Горение гидрата метанаГидрат метана (формула CH4·5.75H2O или 4CH4·23H2O), или метангидрат — супрамолекулярное соединение метана с водой, устойчив при низких температурах и повышенных давлениях. Это наиболее широко распространённый в природе газовый гидрат — его запасы оцениваются в 1016 кг, что на два порядка превышает мировые запасы нефти[1].
В 40-е годы советские учёные (Стрижов, Мохнаткин, Черский) высказывали гипотезу о наличии залежей газовых гидратов в зоне вечной мерзлоты. В 60-е годы были обнаружены первые месторождения газовых гидратов на севере СССР. С этого момента газовые гидраты начинают рассматриваться как потенциальный источник топлива. Постепенно выяснилось их широкое распространение в океанах и нестабильность при повышении температуры.
Сейчас природные газовые гидраты привлекают к себе особое внимание как возможный источник ископаемого топлива, а также как участник изменений климата (см. Гипотеза о метангидратном ружье).
Газовые гидраты внешне напоминают спрессованный снег, могут гореть, легко распадаются на воду и газ при повышении температуры. Благодаря своей клатратной структуре газовый гидрат объёмом 1 м³ может содержать до 160—180 н.м³ чистого газа.
Большинство природных газов (CH4, C2H6, C3H8, CO2, N2, H2S, изобутан, и т. п.) образуют гидраты, которые существуют при определённых термобарических условиях. Область их существования приурочена к морским донным осадкам и к областям многолетнемёрзлых пород. Преобладающими природными газовыми гидратами являются гидраты метана и диоксида углерода.
Фазовая диаграмма и поле устойчивости гидрата метана в морях и на континентах. В море диапазон устойчивости гидрата метана определяется температурой воды в придонном слое и геотермическим градиентом. Температура воды у дна в северных морях составляет +4 °C. Ниже, в осадочных породах она нарастает в соответствии с геотермическим градиентом, при некоторой температуре гидрат метана становится неустойчив и распадается на воду и метан. Аналогичная картина наблюдается на континентах, но глубина распада гидратов на них зависит от глубины развития вечной мерзлоты.
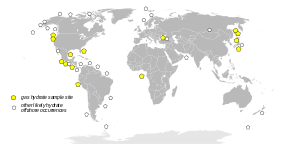 Распространение гидрата метана в морях
Распространение гидрата метана в морях 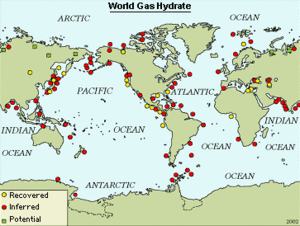
Как следует из фазовой диаграммы гидрата метана, для его образования требуются низкие температуры и относительно высокое давление и чем больше давление, тем выше температура, при которой гидрат метана устойчив. Так, при 0 °C он стабилен при давлении порядка 25 бар и выше. Такое давление достигается, например, в океане на глубине около 250 м. При атмосферном давлении для устойчивости гидрата метана нужна температура около −80 °C. Однако, метангидраты всё же могут довольно долго существовать в условиях низких давлений и при более высокой температуре, но обязательно отрицательной — в этом случае они находятся в метастабильном состоянии, их существование обеспечивает эффект самоконсервации — при разложении метангидраты покрываются ледяной коркой, что мешает дальнейшему разложению.
При увеличении мощности осадков в море и погружении или уменьшении мощности мерзлоты, гидрат метана распадется и на небольшой глубине образуется газовый резервуар, из которого газ может прорваться на поверхность. Такие выбросы действительно наблюдаются в тундре и иногда в морях.
Катастрофический распад гидрата метана считается причиной Поздне-палеоценового термального максимума, геологического события, на границе палеоцена и эоцена, приведшего к вымиранию многих видов животных, изменению климата и седиментации [источник не указан 839 дней].
Гипотеза о пропаже кораблей в Бермудском треугольнике[править | править код]
Процесс прорыва метана из морских залежей газовых гидратов был привлечён для объяснения исчезновения кораблей в Бермудском треугольнике и некоторых других местах. Гипотеза заключается в том, что при подъёме метана к поверхности вода насыщается пузырьками газа и плотность смеси резко падает, в результате корабль теряет плавучесть и тонет. Есть предположение, что поднявшись в воздух, метан может вызвать также крушение самолётов — например, из-за понижения плотности воздуха, которое приводит к снижению подъёмной силы и искажению показаний альтиметров. Кроме того, метан в воздухе может привести к остановке двигателей или взрыву.
Экспериментальным путём была действительно подтверждена возможность достаточно быстрого (в пределах десятков секунд) затопления судна, оказавшегося на границе выброса газа в случае, если газ выделяется одним пузырём, размер которого больше или равен длине судна. Однако остаётся открытым вопрос о таких выделениях газа. Кроме того, гидрат метана находится и в других местах в мировом океане, где не было зафиксировано массовых случаев пропажи кораблей.
Коммерческая добыча газа из гидратных залежей[править | править код]
В августе 2006 года было объявлено, что китайские бизнесмены инвестируют 800 млн юаней (100 млн долларов) в течение следующих 10 лет для изучения возможности добычи газа из гидратных залежей[2]. Бергенский университет (Норвегия) разработал методику внедрения CO2 в отложения гидратов с последующим извлечением CH4. 12 марта 2013 года ConocoPhillips совместно с Japan Oil, Gas and Metals National Corporation (JOGMEC) объявили об удачном применении данного метода недалеко от Японии[3][4].
В мае 2017 года Япония и Китай объявили о прорыве в вопросе добычи газа из залежей гидрата [5]. Однако консенсус нефтегазовой индустрии заключается в том, что до промышленной добычи гидратов пройдут годы[6].
При добыче и транспортировке природного газа в газообразной форме гидраты могут образовываться в стволах скважин, промысловых коммуникациях и магистральных газопроводах. Отлагаясь на стенках труб, гидраты резко уменьшают их пропускную способность. Для борьбы с образованием гидратов на газовых промыслах вводят в скважины и трубопроводы различные ингибиторы (метиловый спирт, гликоли, 30%-ный раствор CaCl2), а также поддерживают температуру потока газа выше температуры гидратообразования с помощью подогревателей, теплоизоляции трубопроводов и подбора режима эксплуатации, обеспечивающего максимальную температуру газового потока. Для предупреждения гидратообразования в магистральных газопроводах наиболее эффективна газоосушка — очистка газа от паров воды.
Гипотеза о метангидратном ружье — Википедия
Гипотеза о метангидратном ружье (англ. clathrate gun hypothesis) — обобщённое наименование для серии гипотез о том, что растущая температура океана (и/или падение его уровня) может запустить внезапное высвобождение метана из отложений гидратов метана под морским дном, что, ввиду того, что метан является сильным парниковым газом, в свою очередь приведёт к дальнейшему росту температур и дальнейшей дестабилизации гидратов метана — в результате запуская самоусиливающийся процесс, в той же мере неостановимый, как уже начавшийся выстрел из ружья
В своей исходной форме гипотеза предполагает, что «метангидратное ружьё» может привести к самоусиливающемуся внезапному глобальному потеплению в течение времени, меньшего, чем время человеческой жизни,[1] и могло быть причиной периодов потепления в течение и в конце последнего ледникового периода.[2] Это предположение впоследствии не подтвердилось[3][4]. Однако ряд более поздних исследований показывает, что самоусиливающееся разложение метангидратов могло приводить к резким изменениям океана и атмосферы Земли несколько раз в прошлом в течение промежутков времени в десятки тысяч лет; наиболее заметно среди этих событий массовое пермское вымирание, произошедшее 251 миллион лет назад, когда вымерло 96 % видов земных организмов. [5]
Метановые гидраты представляют собой твердое вещество, образуемое при взаимодействии природного газа и воды при определенных температурных условиях и давлении, которое содержит в своей кристаллической решётке много метана. Огромное количество гидрата метана было найдено под отложениями под океанским дном по всей Земле. Внезапное высвобождение большого количества природного газа из газовых гидратов может быть причиной прошлых, будущих и нынешних климатических изменений. Главный результат высвобождения метана — это рост температуры. Считается, что это было основным фактором потепления на 6 °C во время пермского вымирания, поскольку метан является гораздо более сильным парниковым газом, чем CO
Возможные события, связанные с высвобождением гидратов метана[править | править код]
Два события, вероятно связанные с этим — это массовое пермское вымирание и позднепалеоценовый термальный максимум. Такое высвобождение могло также сыграть свою роль во внезапном разогреве целиком замёрзшей Земли (Земля-снежок) 630 млн лет назад.[6] Однако потепление в конце последнего ледникового периода считается не связанным с высвобождением метана.
Пермское вымирание[править | править код]
В 2002 году в документальном фильме BBC «День, когда Земля чуть не погибла» (The Day the Earth Nearly Died) были просуммированы последние открытия и гипотезы относительно пермского вымирания. Пол Вигнал исследовал пермские отложения в Гренландии, где присутствуют скальные слои, лишённые морской жизни, толщиной в десятки метров. Благодаря такой широкой шкале он смог вычислить время событий более точно и установить, что вымирание длилось примерно 80 000 лет. Оно отражено в трёх различных слоях с разными остатками растений и животных. Данное вымирание, судя по всему, убило морскую и наземную жизнь в разное время. Два периода вымираний наземной жизни разделены одним коротким периодом полного вымирания морской жизни. Однако этот процесс выглядит слишком долгим, чтобы его можно было списать на падение астероида. Наилучшим ключом к разгадке стал баланс изотопов углерода в скалах, который показал увеличение содержания углерода-12 с течением времени. Стандартное объяснение такого скачка — гниение растений — выглядело недостаточным.
Геолог Джерри Дикенс предположил, что большое количество углерода-12 могло высвободиться благодаря разложению замёрзших гидратов метана с морского дна. Эксперименты, проведённые для оценки необходимого роста температур в глубинах океанов, показали, что достаточно будет роста на 5 °C, чтобы запустить процесс разложения.
Похожий механизм: высвобождение растворённого метана[править | править код]
Джордж Рёскин, исследуя границу перми и триаса[7], исследовал возможность того, что массовые вымирания связаны с исключительно быстрым (взрывным) выделением растворённого метана (и других растворённых газов, таких как углекислый газ и сероводород), которые скапливаются в океанических водах, подверженных застою и аноксии.
Благодаря тому, что нынешние уровни CO2 уже превысили 400 ppm и продолжают расти с постепенным ускорением[8], дестабилизация гидратов метана может стать неконтролируемым механизмом с положительной обратной связью, который приведёт к опасному увеличению температур. К счастью, большая часть гидратов залегает чересчур глубоко, чтобы быстро среагировать на изменение температуры, и исследование, проведённое Арчером в 2007 году, предполагает, что высвобождение метана внесёт лишь небольшой вклад в общий парниковый эффект.[9] Залежи гидратов метана дестабилизируются начиная с самой глубокой части их зоны стабильности, которая обычно находится в сотнях метров под дном моря.
Значительное и постоянное увеличение температуры океана в конце концов приведёт к нагреву отложений под морским дном и, как следствие, к распаду самых глубоких слоёв гидратов метана, но на это потребуются несколько тысячелетий или даже больше.[9] Одним исключением могут быть гидраты метана в Северном Ледовитом океане, где они могут существовать в более мелких водах, будучи стабилизированными низкими температурами, а не высоким давлением; и могут быть на грани стабильности на меньшей глубине под океанским дном, будучи стабилизированы «крышкой» из вечной мерзлоты, предотвращающей высвобождение метана.
Недавние исследования, проведённые в Сибирской Арктике, показали, что уже высвободились миллионы тонн метана — по-видимому, за счёт разрывов в вечной мерзлоте на морском дне.[10]. В результате этого его концентрация в некоторых регионах выросла более чем в 100 раз.[11] Избыток метана был обнаружен в отдельных местах в месте впадения реки Лены и на границе между Морем Лаптевых и Восточно-сибирским морем. Часть плавления может быть результатом геологического нагрева, но большая часть таяния, по-видимому, связана со значительно увеличившимся объёмом талых вод, сбрасываемых сибирскими реками, текущими на север.[12] Современный уровень выбросов метана ранее оценивался как 0,5 мегатонны в год.[13] Шахова и др. (2008) оценивает, что не менее 1400 гигатонн углерода в настоящий момент заперто в виде метана и гидратов метана под арктической подводной вечной мерзлотой, и 5—10 процентов от этого количества тает через открытые проталины в этой вечной мерзлоте. Они приходят к выводу, что «резкое высвобождение вплоть до 50 гигатонн гидратов весьма вероятно в любой момент». Это увеличит содержание метана в атмосфере в 12 раз.[14][15]. Это будет эквивалентно по парниковому эффекту удвоению текущего уровня CO2.
В 2008 году США определили потенциальную дестабилизацию гидратов метана в Арктике как один из четырёх наиболее серьёзных сценариев климатических изменений, которые должны исследоваться приоритетным образом.[16] Как отметила та же Шахова в 2015 году, в то время как на участках мирового океана за пределами России влияние деградации подводной вечной мерзлоты только начинается, именно на сибирском шельфе оно приняло угрожающий масштаб[17].
По состоянию на 2017 год скорость таяния подводной шельфовой мерзлоты в Восточно-Сибирском море составляет около 18 см в год, что гораздо выше прогнозных оценок. На многих участках истончение прикрывающего метановые гидраты льда уже приближается к критическому уровню, после которого метан из гидратов может начать поступать в водную толщу и атмосферу[18][19].
Согласно Джорджу Рёскину, внезапное высвобождение метана (подобное лимнологической катастрофе на озере Ниос) из толщи океанских вод может привести как к глобальному потеплению, так и к глобальному похолоданию. Взрыв и горение метана приведут к образованию большого количества смога и пыли, которые приведут к глобальному похолоданию. Метан и углекислота, наоборот, приведут к глобальному потеплению. Профессор Рёскин пишет, что трудно предсказать, какое из явлений пересилит. При этом Рёскин отмечает, что вопрос о том, сколько метана растворено в воде на большой глубине океана, нуждается в дальнейшем изучении. Примером застойного бассейна, в котором накапливаются газы (сероводород) и наблюдается аноксия, является Чёрное море.
Последствия взрыва океана за счёт метана будут катастрофическими для наземной жизни. Образно говоря, взрывающийся регион «вскипает», выбрасывая огромные количества метана и других газов (углекислоты, сероводорода) в атмосферу, и заливая большие поверхности суши. Хотя чистый метан легче воздуха, метан, нагруженный каплями воды — тяжелее воздуха, и в силу этого распространяется по поверхности Земли, смешиваясь с воздухом и (теряя воду) в форме дождя. Смесь метана и воздуха взрывоопасна при концентрациях от 5 до 15 процентов. Если такая смесь образуется около поверхности Земли и воспламенится молнией, то взрывы и пожары уничтожат большую часть наземной жизни, также приведя к выделению большого количества углекислоты. Огненные штормы направят смог и пыль в верхние слои атмосферы, где они сохранятся в течение нескольких лет. Как следствие, затемнение атмосферы и глобальное похолодание могут быть дополнительным негативным эффектом. И наоборот, углекислота и оставшийся метан создают дополнительный парниковый эффект, который может привести к глобальному потеплению. Результат соревнования между охлаждением и нагреванием предсказать трудно.[1]
- В книге «Мать бурь» (англ. Mother of Storms) Джон Барнс (англ.) предлагает фантастический пример катастрофических климатических изменений, вызванных выделением метана.
- ↑ 1 2 James P. Kennett, Kevin G. Cannariato, Ingrid L. Hendy, and Richard J. Behl, (2003) Methane Hydrates in Quaternary Climate Change: The Clathrate Gun Hypothesis, Washington, DC: American Geophysical Union. ISBN 0-87590-296-0
- ↑ James P. Kennett, Kevin G. Cannariato, Ingrid L. Hendy, Richard J. Behl (2000), Carbon Isotopic Evidence for Methane Hydrate Instability During Quaternary Interstadials, Science 288 (5463: Apr 7), 128—133 DOI:10.1126/science.288.5463.128
- ↑ Todd Sowers (2006), Late Quaternary Atmospheric CH4 Isotope Record Suggests Marine Clathrates Are Stable, Science 311 (5762: Feb 10), 838—840 DOI:10.1126/science.1121235
- ↑ Hinrich Schaefer, Michael J. Whiticar, Edward J. Brook, Vasilii V. Petrenko, Dominic F. Ferretti, Jeffrey P. Severinghaus (2006), Ice Record of 13C for Atmospheric CH4 Across the Younger Dryas-Preboreal Transition, Science, 313 (5790: Aug 25) 1109—1112 DOI:10.1126/science.1126562
- ↑ The Day The Earth Nearly Died, BBCHorizon, 2002
- ↑ Martin Kennedy, David Mrofka and Chris von der Borch (2008), Snowball Earth termination by destabilization of equatorial permafrost methane clathrate, Nature 453 (29 May), 642—645
- ↑ Gregory Ryskin. Methane-driven oceanic eruptions and mass extinctions (англ.) // Geology : journal. — No. September 2003; v. 31; no. 9. — P. 741—744. Архивировано 28 августа 2008 года.
- ↑ Mauna Loa CO2 monthly mean data (англ.). Earth System Research Laboratory. Дата обращения 18 февраля 2019.
- ↑ 1 2 Archer, D. Methane hydrate stability and anthropogenic climate change (англ.) // Biogeosciences (англ.)русск. : journal. — 2007. — Vol. 4, no. 4. — P. 521—544. См. также blog summary.
- ↑ Compare: Methane bubbling through seafloor creates undersea hills Архивировано 11 октября 2008 года., Monterey Bay Aquarium Research Institute, 5 February 2007
- ↑ Steve Connor, Exclusive: The methane time bomb, The Independent, 23 September 2008
- ↑ Translation of a blog entry by Örjan Gustafsson, expedition research leader, 2 September 2008
- ↑ N. Shakhova, I. Semiletov, A. Salyuk, D. Kosmach, and N. Bel’cheva (2007), Methane release on the Arctic East Siberian shelf, Geophysical Research Abstracts, 9, 01071
- ↑ N. Shakhova, I. Semiletov, A. Salyuk, D. Kosmach (2008), Anomalies of methane in the atmosphere over the East Siberian shelf: Is there any sign of methane leakage from shallow shelf hydrates? Архивная копия от 22 декабря 2012 на Wayback Machine, EGU General Assembly 2008, Geophysical Research Abstracts, 10, EGU2008-A-01526
- ↑ Volker Mrasek, A Storehouse of Greenhouse Gases Is Opening in Siberia, Spiegel International Online, 17 April 2008
- ↑ U.S. National Labs Probe Abrupt Climate Change (неопр.). Environment News Service (22 сентября 2008). Архивировано 19 марта 2012 года.
- ↑ ТАСС: Наука — Ученые: выбросы метана в Арктике могут спровоцировать глобальное потепление на планете
- ↑ Таяние подводной вечной мерзлоты на арктическом шельфе ускорилось (рус.), Пронедра (9 августа 2017). Дата обращения 9 августа 2017.
- ↑ Подводная мерзлота на арктическом шельфе тает быстрее, чем считалось прежде
- Иващенко О. В. «Потепление глубинных вод Мирового океана и стабильность метангидратов»
- Homepage of Dr. Paul Wignal, Reader in Palaeoenvironments, University of Leeds.
- (Abstract) Methane Hydrates in Quaternary Climate Change: The Clathrate Gun Hypothesis
- Preface to the Clathrate Hydrates special issue
- Benton, Michael J.; Richard J. Twitchett. How to kill (almost) all life: the end-Permian extinction event (англ.) // TRENDS in Ecology and Evolution : journal. — 2003. — July (vol. 18, no. 7). — P. 358—365. — DOI:10.1016/S0169-5347(03)00093-4. Архивировано 18 апреля 2007 года., cited by 21 other articles.
- Svensen, Henrik; Sverre Planke, Anders Malthe-Sørenssen, Bjørn Jamtveit, Reidun Myklebust, Torfinn Rasmussen Eidem and Sebastian S. Rey. Release of methane from a volcanic basin as a mechanism for initial Eocene global warming (англ.) // Nature : journal. — 2004. — 3 June (vol. 429). — P. 542—545.
- Thomas, Deborah J.; James C. Zachos, Timothy J. Bralower, Ellen Thomas and Steven Bohaty. Warming the fuel for the fire: Evidence for the thermal dissociation of methane hydrate during the Paleocene-Eocene thermal maximum (англ.) // Geology : journal. — 2002. — December (vol. 30, no. 12). — P. 1067—1070.
- Ryskin, Gregory. Methane-driven oceanic eruptions and mass extinctions (англ.) // Geology : journal. — 2003. — September (vol. 31, no. 9). — P. 741—744. Архивировано 28 августа 2008 года.
- Archer, D.; Buffett, B. (2004). «Temperature sensitivity and time dependence of the global ocean clathrate reservoir». American Geophysical Union, Fall Meeting.
Парниковые газы — Википедия
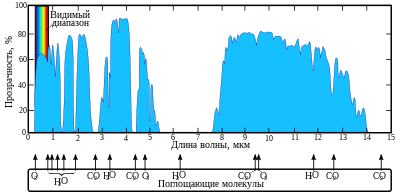
Парнико́вые га́зы — газы с высокой прозрачностью в видимом диапазоне и с высоким поглощением в среднем и дальнем инфракрасном диапазонах. Присутствие таких газов в атмосферах планет приводит к парниковому эффекту.
Основными парниковыми газами Земли являются водяной пар, углекислый газ, метан и озон (в порядке их оцениваемого воздействия на тепловой баланс)[1]. Потенциально в парниковый эффект могут вносить вклад и антропогенные галогенированные углеводороды и оксиды азота, однако ввиду низких концентраций в атмосфере оценка их вклада проблематична.
Основными парниковыми газами в атмосферах Венеры и Марса является диоксид углерода, составляющие 96,5% и 95,3% атмосфер этих планет, в атмосфере Земли — водяной пар.
Водяной пар является основным естественным парниковым газом, который ответственен более чем за 60 % эффекта для Земли.
В то же время, увеличение температуры Земли, вызванное другими факторами, увеличивает испарение и общую концентрацию водяного пара в атмосфере при практически постоянной относительной влажности, что, в свою очередь, повышает парниковый эффект. Таким образом, возникает некоторая положительная обратная связь[прояснить]. С другой стороны, повышение влажности способствует повышению облачности, а облака в атмосфере отражают прямой солнечный свет, тем самым увеличивая альбедо Земли. Повышенное альбедо приводит к антипарниковому эффекту, несколько уменьшая общее количество поступающего солнечного излучения к поверхности Земли и дневной прогрев нижних слоёв атмосферы.
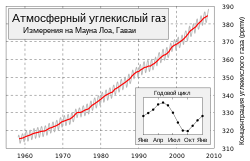 Изменение концентрации CO2 за 50 лет.
Изменение концентрации CO2 за 50 лет.Источниками углекислого газа в атмосфере Земли являются вулканические выбросы, жизнедеятельность биосферы, деятельность человека (антропогенные факторы).
По последним научным данным основным источником углекислого газа в атмосфере являются антропогенные источники[источник не указан 55 дней], такие как сжигание ископаемого топлива; сжигание биомассы, включая сведение лесов; некоторые промышленные процессы приводят к значительному выделению углекислоты (например, производство цемента).
Основными потребителями углекислого газа являются растения (однако в состоянии приблизительного динамического равновесия большинство биоценозов за счёт гниения биомассы производит приблизительно столько же углекислого газа, сколько и поглощает) и мировой океан[3] (диоксида углерода растворено в воде земных океанов в сто раз больше, чем присутствует в атмосфере, он содержится в виде гидрокарбонат- и карбонат-ионов, которые получаются в результате реакций между скальными породами, водой и CO2).
Антропогенная эмиссия увеличивает концентрацию углекислого газа в атмосфере, что, предположительно, является главным фактором изменения климата. Углекислый газ является «долго живущим» в атмосфере. Согласно современным научным представлениям, возможность дальнейшего накапливания СО2 в атмосфере ограничена риском неприемлемых последствий для биосферы и человеческой цивилизации, в связи с чем его будущий эмиссионный бюджет является конечной величиной. Концентрация углекислого газа в атмосфере Земли по сравнению с доиндустриальной эпохой (1750 г.) в 2017 г. возросла с 277 до 405 ppm на 46 %[2].
Вместе с годовым ростом 2,20±0,01 ppm, в течение года наблюдается периодическое изменение концентрации амплитудой 3—9 ppm, которое следует за развитием вегетационного периода в Северном полушарии. Потому как в северной части планеты располагаются все основные континенты, влияние растительности Северного полушария доминирует в годовом цикле концентрации CO2. Уровень достигает максимума в мае и минимума в октябре, когда количество биомассы, осуществляющей фотосинтез, является наибольшим[4].
Время жизни метана в атмосфере составляет примерно 10 лет. Сравнительно короткое время жизни в сочетании с большим парниковым потенциалом позволяет пересмотреть тенденции глобального потепления в ближайшей перспективе.
До последнего времени считалось, что парниковый эффект от метана в 25 раз сильнее, чем от углекислого газа. Однако теперь Межправительственная группа экспертов по изменению климата ООН (IPCC) утверждает, что «парниковый потенциал» метана ещё опаснее, чем оценивалось раньше. Как следует из доклада IPCC, который цитирует Die Welt, в расчете на 100 лет парниковая активность метана в 28 раза сильнее, чем у углекислого газа, а в 20-летней перспективе — в 84 раза[5][6].
В анаэробных условиях (в болотах, переувлажнённых почвах, кишечнике жвачных животных) метан образуется биогенно в результате жизнедеятельности некоторых микроорганизмов.
Основными антропогенными источниками метана являются животноводство, рисоводство, горение биомассы (в т. ч. сведение лесов).
Как показали недавние исследования, быстрый рост концентрации метана в атмосфере происходил в первом тысячелетии нашей эры (предположительно в результате расширения сельхозпроизводства и скотоводства и выжигания лесов). В период с 1000 по 1700 годы концентрация метана упала на 40 %, но снова стала расти в последние столетия (предположительно в результате увеличения пахотных земель, пастбищ и выжигания лесов, использования древесины для отопления, увеличения поголовья домашнего скота, количества нечистот, выращивания риса). Некоторый вклад в поступление метана дают утечки при разработке месторождений каменного угля и природного газа, а также эмиссия метана в составе биогаза, образующегося на полигонах захоронения отходов.
Анализ пузырьков воздуха в древних ледниках свидетельствует о том, что сейчас в атмосфере Земли больше метана, чем в любое время за последние 400000 лет. С 1750 года средняя глобальная атмосферная концентрация метана возросла на 257 процентов от приблизительно 723 до 1859 частей на миллиард по объёму (ppbv[7]) в 2017 году[2]. За последнее десятилетие, хотя концентрация метана продолжала расти, скорость роста замедлилась. В конце 1970-х годов темпы роста составили около 20 ppbv в год. В 1980-х годов рост замедлился до 9—13 ppbv в год. В период с 1990 по 1998 наблюдался рост между 0 и 13 ppbv в год. Недавние исследования (Dlugokencky и др.) показывают устойчивую концентрацию 1751 ppbv между 1999 и 2002 гг.[8]
Метан удаляется из атмосферы посредством нескольких процессов. Баланс между выбросами метана и процессами его удаления в конечном итоге определяет атмосферные концентрации и время пребывания метана в атмосфере. Доминирующим является окисление с помощью химической реакции с гидроксильными радикалами (ОН). Метан реагирует с ОН в тропосфере, производя СН3 и воду. Стратосферное окисление также играет некоторую (незначительную) роль в устранении метана из атмосферы. На эти две реакции с ОН приходится около 90 % удаления метана из атмосферы. Кроме реакции с ОН известно ещё два процесса: микробиологическое поглощение метана в почвах и реакция метана с атомами хлора (Cl) на поверхности моря. Вклад этих процессов 7 % и менее 2 % соответственно[9].
Озон необходим для жизни, поскольку защищает Землю от жёсткого ультрафиолетового излучения Солнца.
Однако ученые различают стратосферный и тропосферный озон. Первый (так называемый озоновый слой) является постоянной и основной защитой от вредного излучения. Второй же считается вредным, так как может переноситься к поверхности Земли и ввиду своей токсичности вредить живым существам. Кроме того, повышение содержания именно тропосферного озона внесло вклад в рост парникового эффекта атмосферы. По наиболее широко распространенным научным оценкам, вклад озона составляет около 25 % от вклада СО2[10].
Большая часть тропосферного озона образуется, когда оксиды азота (NOx), окись углерода (СО) и летучие органические соединения вступают в химические реакции в присутствии кислорода, водяных паров и солнечного света. Транспорт, промышленные выбросы, а также некоторые химические растворители являются основными источниками этих веществ в атмосфере. Метан, атмосферная концентрация которого значительно возросла в течение последнего столетия, также способствует образованию озона. Время жизни тропосферного озона составляет примерно 22 дня, основными механизмами его удаления являются связывание в почве, разложение под действием ультрафиолетовых лучей и реакции с радикалами OH и NO2[11].
Концентрации тропосферного озона отличаются высоким уровнем изменчивости и неравномерности в географическом распределении. Существует система мониторинга уровня тропосферного озона в США[12] и Европе[13], основанная на спутниках и наземном наблюдении. Поскольку для образования озона требуется солнечный свет, высокие уровни озона наблюдаются обычно в периоды жаркой и солнечной погоды.
Увеличение концентрации озона вблизи поверхности имеет сильное негативное воздействие на растительность, повреждая листья и угнетая их фотосинтетический потенциал. В результате исторического процесса увеличения концентрации приземного озона, вероятно, была подавлена способность поверхности суши поглощать СО2 и поэтому увеличились темпы роста СО2 в XX веке. Ученые (Sitch и др. 2007) полагают, что это косвенное воздействие на климат увеличило почти вдвое вклад приземного озона в изменение климата. Снижение загрязнения нижней тропосферы озоном может компенсировать 1-2 десятилетия эмиссии СО2, при этом экономические издержки будут относительно невелики (Wallack и Ramanathan, 2009)[14].
Парниковая активность закиси азота в 298 раз выше, чем у углекислого газа. Кроме того, оксиды азота могут влиять на озоновый слой в целом.
С 1750 года средняя глобальная атмосферная концентрация закиси азота N2O возросла на 122 процента от приблизительно 269 до 329 частей на миллиард по объёму (ppbv) в 2017 году[2].
Парниковая активность фреонов в 1300-8500 раз выше, чем у углекислого газа. Основным источником фреона являются холодильные установки и аэрозоли.
- ↑ Kiehl, J. T.; Kevin E. Trenberth. Earth’s Annual Global Mean Energy Budget (англ.) // Bulletin of the American Meteorological Society (англ.)русск. : journal. — 1997. — February (vol. 78, no. 2). — P. 197—208. — ISSN 0003-0007. — DOI:10.1175/1520-0477(1997)078<0197:EAGMEB>2.0.CO;2.
- ↑ 1 2 3 4 5 6 Всемирная метеорологическая организация 22.11.2018 The state of the global climate
- ↑ Ученые: океан поглощает около трети выбросов СО2, связанного с деятельностью человека
- ↑ (англ.) Carbon Dioxide Information Analysis Center (CDIAC) — Frequently Asked Questions
- ↑ Почему у российского газа нет экологичной альтернативы — BBC Russian
- ↑ IPCC (Intergovernmental Panel on Climate Change). IPCC, 2014: Climate Change 2014: Synthesis Report. Contribution of Working Groups I, II and III to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change [Core Writing Team, R.K. Pachauri and L.A. Meyer (eds.). IPCC, Geneva, Switzerland, 151 pp.] (неопр.) (недоступная ссылка). Climate Change 2014: Synthesis Report.. IPCC (2015). Дата обращения 4 августа 2016. Архивировано 12 ноября 2018 года.
- ↑ Объемных частей на миллиард.
- ↑ Greenhouse Gas Online
- ↑ The IPCC Assessment Reports
- ↑ Изменение климата 2007. Обобщающий доклад Межправительственной группы экспертов по изменению климата, на русском (неопр.) (недоступная ссылка). Дата обращения 18 августа 2012. Архивировано 30 октября 2012 года.
- ↑ Stevenson et al. Multimodel ensemble simulations of present-day and near-future tropospheric ozone (неопр.). American Geophysical Union (2006). Дата обращения 16 сентября 2006.
- ↑ The Air Quality Index (неопр.) (недоступная ссылка). Дата обращения 22 января 2010. Архивировано 24 ноября 2005 года.
- ↑ Live map of ground-level ozone
- ↑ The Copenhagen Diagnosis: Climate Science Report
Рекомендуемая литература[править | править код]
Метан угольных пластов — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 23 августа 2014; проверки требуют 13 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 23 августа 2014; проверки требуют 13 правок.Метан угольных пластов — метан, содержащийся в сорбированном (связанном) состоянии в системе естественных трещин угля. При бурении скважин давление в устье скважины становится ниже, чем давление в пласте за счет чего происходит приток находящейся в трещинах жидкости, а в дальнейшем и метана. Для добычи угольного метана обычно бурятся вертикальные скважины на глубину значительно превышающую залегание водоносных горизонтов. Наиболее популярные методы интенсификации добычи — гидроразрыв пласта, бурение горизонтально-направленных скважин и, в некоторых случаях, кавитация.
Не имеет никакого отношения к дегазации угольных шахт.
Оценка геологических ресурсов метана угольных пластов[1]
Промышленная добыча метана угольных пластов началась в США в начале 1980-х годов. В 2000 году в США было добыто 40 млрд м³ метана угольных пластов, что составляло 7 % суммарной добычи газа в стране.
В результате добычи угля в Китае выбросы метана в атмосферу составляют 6—19 млрд м³ в год. В 1996 году была учреждена Китайская Объединенная Корпорация по метану из угольных пластов (CUCBM). К 2009 году добыча газа выросла до 700 миллионов м³. В 2009 году началось строительство более 3600 буровых скважин для его добычи[2].
Россия[править | править код]
В России принята программа «Метан Кузбасса». Кузбасс может производить около 20 млрд м³ метана ежегодно. Ресурсы метана в Кузбассе оцениваются в 13 трлн м³[3][4]. Программа «Метан-Кузбасс» реализуется в три этапа: поисково-оценочные и геологоразведочные работы (2008—2009), опытно-промышленная эксплуатация и наращивание объёмов добычи (с 2010), выход на проектную промышленную добычу. В 2010 году на Талдинской площади пущен первый промысел по добыче газа метана из угольных пластов Кузнецкого бассейна[5].
Проект по добыче в Нарыкско-Осташкинском требует инвестиций в 5,3 млрд руб, 20 скважин добыли 20 млн м³ газа за 4 года.[6]
Метан – Уикипедия
Метанът е химично съединение с химична формула CH4. Това е най-простият алкан. Ъгълът между атомите на метана е 109,5 градуса.
Това е най-простият наситен въглеводород. Той е безцветен газ, без миризма, с температура на топене -182,5 °C и температура на кипене -161,5 °C. При -11 °C под значително налягане се втечнява. Той е основна съставка на природния газ, съпътстващ нефта или намиращ се в газови находища, и се образува при приблизително същите геоложки процеси както нефта. Метан се образува и при разлагане на растителни материали в отсъствието на кислород в блатисти места, поради което се нарича още и блатен газ. Среща се и в каменовъглените мини, където е известен като газ гризу или рудничен газ. Промишлено се получава при прекарването на един обем СО и три обема Н2 над фино раздробен никелов катализатор при атмосферно налягане и температура 200 – 300 °C. Освен на Земята, метан е открит и на други планети в Слънчевата система.
Горенето на метана в присъствието на кислород води до образуването на въглероден двуокис и вода. Големите залежи на природен газ правят метана привлекателен като гориво. Въпреки това, тъй като той е газ, при нормална температура и налягане метанът трудно може да се транспортира от неговия източник. Най-често се транспортира под налягане по тръбопроводи или в специални танкери, където природният газ е втечнен под високо налягане и ниска температура; понякога се транспортира и нагнетен в бутилки под налягане.
Химически метанът е сравнително инертно съединение, но с хлора реагира с взрив при нормална температура, а при ниски температури се получава метилхлорид. При смесване с въздух в известни пропорции образува взривоопасна смес, особено в затворени помещения (напр. мини, жилища). Използва се при производството на метилхлорид, метиленхлорид, водород, амоняк, при получаването на сажди. Използва се и като гориво, предимно в котли, но също и в двигатели с вътрешно горене (с искрово запалване и дизелови, в турбини).
Метан е също и търговско наименование на природния газ, тъй като предлаганият в търговската мрежа природен газ се състои над 90% от наситения въглеводород.
-

Двуизмерно изображение
-

Триизмерно изображение
Метанът е открит и изолиран от Алесандро Волта между 1776 г. и 1778 г., когато е изследван блатен газ от езерото Лаго Маджоре.
Метанът е един от основните парникови газове. Времето му на живот в атмосферата е около 10 години, като най-често влиза в реакция с хидроксилни радикали, вследствие на което се получава въглероден двуокис и вода.
Метанът оказва влияние и на разграждането на озоновия слой.
| Формула | Моларна маса | Плътност | Точка на топене | Точка на кипене | Разтворимост във вода | Пламна температура | КГВ |
|---|---|---|---|---|---|---|---|
| CH4 | 16.042 g/mol | 0.717 kg/m3 (газ, 0 °C) 416 kg/m3 (течност) | -182.5 °C | -161.6 °C | 35 mg/L (17 °C) | -188 °C | 5 – 15 обемни % |
Наличието на метан в атмосферата на земята през 1998 г. е 1745 части на милиард (ppb), в сравнение с 700 ppb през 1750 г. До 2008 г. обаче съдържанието на метан в атмосферата е останало на нива от 1998 г. насам – около 1800 ppb. До 2010 г. нивото на метана в атмосферата е най-ниско в Арктика, с измерени стойности около 1850 ppb. Това е най-високото регистрирано ниво от 400 хиляди години. Исторически концентрацията метан в атмосферата на света варира между 300 и 400 ppb по време на ледниковия период и между 600 – 700 ppb през топлите междуледникови периоди.
Метанът е основният компонент на природния газ, около 87% от неговия обем. При стайна температура и нормално налягане, метанът е без цвят и мирис; миризмата характерна за природния газ, който се използва в домовете е изкуствена мярка за безопасност, причинена от добавяне на „ароматизатори“, често метанетиол или етанетиол. Метанът е с температура на кипене от -161 °C при налягане от една атмосфера. Като газ е запалим в тесен диапазон от концентрации (5 – 15 обемни %) с въздуха.
Опасност за човешкото здраве[редактиране | редактиране на кода]
Метанът не е токсичен, но е изключително запалим и може да образува взривоопасни смеси с въздуха. Метанът бурно реагира с окислители, халогени, както и някои халоген-съдържащи съединения. Метанът може да предизвика задушаване, измествайки кислорода от въздуха в затворено пространство. Задушаване може да възникне, ако концентрацията на кислород спадне под 19,5%.
Химически реакции на метана[редактиране | редактиране на кода]
Основните химически реакции с метан са горене и халогениране. Като цяло реакциите с метан са трудни за контролиране. Трудно е да се постигне например частично окисление на метанол, тъй като реакцията обикновено прогресира до въглероден двуокис и вода.
Горене[редактиране | редактиране на кода]
Горенето на метана протича на няколко етапа:
Първоначално се образува формалдехид (HCHO или H2CO). Формалдехидът освобождава радикали HCO—, които след това се превръщат във въглероден оксид (CO). Процесът се нарича оксидативна пиролиза:
- CH4 + O2 → CO + H2 + H2O
След оксидативната пиролиза, H2 се окислява като се образува H2O и се освобождава топлина. Това се случва много бързо, обикновено значително по-малко от една милисекунда.
- 2 H2 + O2 → 2 H2O
На последно място, CO се окислява до CO2 и освобождава още топлина. Този процес като цяло е по-бавен от предишните химични, и обикновено изисква няколко милисекунди, за да се приключи.
- 2 CO + O2 → 2 CO2
В резултат на горното е следната обща формула:
- CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(l) + 891 kJ/mol (при стандартни условия),
където в скоби „g“ означава газообразно състояние и в скоби „l“ означава течна форма.
Изместване на водород от молекулата[редактиране | редактиране на кода]
Ковалентната връзка въглерод-водород в метана е сред най-силните от всички въглеводороди и поради това използването му като изходна суровина химически е ограничено. Въпреки здравата C-H облигациия, Ch5 все още е основната суровина за производството на водород в риформинг с водна пара. Търсенето на катализатори, които могат да улеснят разкъсването на C-H връзката на метана и други алкани е в областта на научните изследвания с голямо стопанско значение.
Реакции с халогени[редактиране | редактиране на кода]
Метанът реагира с всички халогени при подходящи условия по следния начин:
- CH4 + X2 → CH3X + HX
където Х са халогените: хлор (Cl), бром (Br), или йод (I). С флуор (F) се изместват всички водородни атоми. Получава се тетрафлуорометан (CF4) и се отделя флуороводород (HF). Този процес се нарича халогениране. Когато X е Cl, реакцията притича по следния начин:
1. Формиране на радикали:
- Cl2→△UV2Cl∙−239kJ{\displaystyle \mathrm {Cl_{2}{\xrightarrow[{\triangle }]{UV}}2Cl^{\bullet }-239\;kJ} }
Необходимата енергия се получава от въздействието на ултравиолетови лъчи или загряване.
2. Замяна на радикалите:
- CH4 + Cl• → CH3• + HCl + 14 kJ
- CH3• + Cl2 → CH3Cl + Cl• + 100 kJ
3. Унищожаване на радикалите:
- 2 Cl• → Cl2 + 239 kJ
- CH3• + Cl• → CH3Cl + 339 kJ
- 2 CH3• → CH3CH3 + 347 kJ
Гориво[редактиране | редактиране на кода]
Метанът е важен за производството на електричество чрез изгаряне като гориво в газова турбина или парен котел. В сравнение с други въглеводородни горива, изгарянето на метан произвежда по-малко въглероден диоксид за всяка единица произведена топлина. Около 891 kJ/mol е топлината произведена от горенето на метана. Тя е по-малко, отколкото при горенето на всеки друг въглеводород, но отношението от топлината на изгаряне (891 kJ/mol) към молекулна маса (16.0 g/mol) показва, че метанът, който е най-простият въглеводород, произвежда повече топлина за единица тегло (55.7 kJ/g) в сравнение с други сложни въглеводороди. Много градове са газифицирани и метанът се ползва за битови нужди. В този си вид е познат като природен газ и се счита, че енергийното съдържание е 39 мегаджаула на кубичен метър.
Метан под формата на компресиран природен газ се използва като гориво на превозните средства и по този начин те са по-екологично чисти, в сравнение с другите изкопаеми горива като бензин и дизелово гориво.
Понастоящем се провеждат изпитания за потенциала на метана като ракетно гориво. Едно от предимствата на метана е, че той е широко разпространен в много части на Слънчевата система и би могъл да бъде събиран на място, осигурявайки гориво за двупосочно пътуване.
Индустриална употреба[редактиране | редактиране на кода]
Метанът се използва в промишлени химически процеси. Той е изходна суровина за производството на водород, метанол, оцетна киселина, оцетен анхидрид. За целта метанът се превръща в смес от въглероден окис и водород чрез риформинг с водна пара. В този процес метанът и парата реагират чрез никелов катализатор при висока температура (700 – 1100 °C).
- Ch5+h3O→700−1100 ∘CNiCO+3h3{\displaystyle \mathrm {CH} _{4}+\mathrm {H_{2}O} {\xrightarrow[{700-1100\ \mathrm {^{\circ }C} }]{\mathrm {Ni} }}\mathrm {CO+3H_{2}} }
- CO + H2O → CO2 + H2
Също така метанът е изходна суровина за производството на ацетилен (при преминаване на метан през електрическа дъга) и хлорметани (хлорметан, дихлорометан, хлороформ и тетрахлорметан). Последните се получават чрез реакция на метана с хлора. Въпреки това, използването на тези химикали намалява. Ацетиленът се заменя с по-евтини заместители, а използването на хлорметаните намалява поради здравословни и екологични проблеми.
Като част от природния газ[редактиране | редактиране на кода]
Основният източник на метан е добивът от геоложки находища, известни като находищата на природен газ. Обикновено там метанът е смесен с други въглеводородни горива и понякога придружен с хелий и азот. Метанът също се произвежда в значителни количества от гниещи органични отпадъци в депа за битови отпадъци.
Алтернативни източници[редактиране | редактиране на кода]
Отделно от газовите находища, алтернативен метод за получаване на метан е чрез производство на биогаз, генериран от ферментация на органични вещества, включително животински тор, утайки от отпадъчни води, твърди битови отпадъци или други биоразградими суровини при анаеробни условия. Метановите хидрати/клатрати (ледена комбинация от метан и вода на дъното на морето, открити в големи количества), са потенциален бъдещ източник на метан.
Промишлено метан може да бъде произведен от въглероден диоксид и водород или въглероден окис и водород чрез химични реакции по метода на Сабатиер или на Фишер-Тропс (макар че Фишер-Тропс обикновено се използва за производството на по-дълги въглеводородни вериги от тази на метана).
Метан е открит или се смята, че съществува на няколко места в Слънчевата система. В повечето случаи се смята, че е бил създаден от абиотични процеси. Възможни изключения са Марс и Титан.
- Луна – открити са следи от изпускане на повърхността;
- Марс – атмосферата съдържа 10 ppb метан. През януари 2009 г. бе обявено, че учени са открили, че планетата изпуска метан в атмосферата в определени области. Това накара някои учени да спекулират, че това може да е знак за биологична активност под повърхността;
- Юпитер – атмосферата му съдържа около 0,3% метан;
- Сатурн – атмосферата съдържа около 0,4% метан;
- Япет
- Титан – атмосферата му съдържа 1,6% метан. На повърхността му има хиляди метанови езера и течащи реки. В горните слоеве на атмосферата метанът се превръща в по-сложни молекули, включително и ацетилен. Това е процес, при който се произвежда и молекулярен водород. Има данни, че ацетиленът и водородът се превръщат в метан в близост до повърхността. Това предполага наличието или на екзотичен катализатор, или на непозната форма на метаногенен живот;
- Енцелад – атмосферата съдържа 1,7% метан;
- Уран – атмосферата съдържа 2,3% метан;
- Ариел – метан се смята за съставна част на повърхността лед Ариел;
- Миранда
- Оберон – около 20% от повърхностния лед на Оберон е съставен от метан, свързан с въглерод/азотни съединения;
- Титания – около 20% от повърхностния лед на Титания се състои от метан, свързан с органични съединения;
- Умбриел – метан е основен елемент в повърхностния лед на Умбриел;
- Нептун – атмосферата съдържа 1,6% метан;
- Тритон – Тритон има разредена атмосфера от азот с малки количества метан в близост до повърхността;
- Плутон – спектроскопски анализ на повърхността на Плутон показва, че тя съдържа следи от метан. През 2015 г. сондата Нови хоризонти заснема ледени полета от замръзнал метан на повърхността;
- Харон – смята се, че метанът присъства на Харон, но това не е напълно потвърдено;
- Ерида – инфрачервена светлина от обекта подсказва за наличие на лед от метан;
- Халеевата комета
- Комета Хиакутаке – наземните наблюдения показват наличие етан и метан в кометата;
- Извънслънчева планетата HD 189733b – Това е първото откриване на органично съединение на планета извън Слънчевата система. Произходът е неизвестен, тъй като високата температура на планетата (700 °C) обикновено благоприятства за образуването на въглероден окис вместо метан;
- Междузвездни облаци
![Общомедия {\mathrm {CH}}_{4}+{\mathrm {H_{2}O}}{\xrightarrow[ {700-1100\ {\mathrm {^{{\circ }}C}}}]{{\mathrm {Ni}}}}{\mathrm {CO+3H_{2}}}](/800/600/https/upload.wikimedia.org/wikipedia/commons/thumb/4/4a/Commons-logo.svg/30px-Commons-logo.svg.png) Общомедия разполага с мултимедийно съдържание за
Общомедия разполага с мултимедийно съдържание заОбсуждение:Метан — Википедия
Чем пахнет метан?
- Ничем см. природный газ Александр Сергеевич 12:06, 18 марта 2006 (UTC)
А как из метана получают синильную кислоту? —Medved’ 0:17, 1 января 2007.
Реакцией с аммиаком.—daim 16:41, 21 октября 2008 (UTC)
Какова низшая концентрация метана в воздухе обеспечивающая устойчивое воспламенение смеси от искры зажигания? 87.103.169.177 04:46, 21 августа 2008 (UTC)
а почему в лабораторном получении используется NaOH, а в конце приписано что КОН всяко лучше? (про сравнительную стоимость их использования я и сам знаю, но как-то некорректно абзац выглядит)
Де можна прочитати про метанове бродіння?
Пишите, пожалуйста, по-русски и подписывайтесь. BurSer 16:27, 13 февраля 2009 (UTC)
Уважаемые господа! В соединении, называемом ацетатом натрия, должен быть натрий. Или вам так не кажется? Найдите, пожалуйста, ошибку. BurSer 16:30, 13 февраля 2009 (UTC)
Написано, нетоксичен и для здоровья не опасен. Но тот газ, который идёт из трубы, однозначно небезопасен для вдыхания, если надышаться, могут быть даже серьёзные последствия. Или это связано с другими компонентами этого газа?—89.110.9.189 00:57, 26 ноября 2010 (UTC)
Перенесено со страницы ВП:СО.Метан в больших количествах и пр. не ядовит. Он малорастворим в воде и крови. Здесь нужно более тщательно подойти к данному вопросу. Возможно вы имели ввиду отравление от одоранта в загазованной среде метана.
Автор сообщения: Александр 217.66.146.191 17:28, 6 января 2012 (UTC)
- Исправлено. Тара-Амингу 18:15, 17 января 2012 (UTC)
- Отменено исправление. Про неядовитость метана Александр может рассказать всем отравившемся этим неядовитым метаном. А они с интересом посшушают. —Tretyak 08:24, 18 января 2012 (UTC)
- Я так понимаю, метан ядовит в закрытых помещениях, поскольку вытеснет кислород, получается кислородное голодание. А одорант это отдушка для метана, применяющаяся, чтобы обнаружить утечку беззапахового метана. По большому счёту, заявитель прав, «нужно более тщательно подойти к данному вопросу». Анатолич1 07:52, 19 января 2012 (UTC)
- Вряд ли можно отравиться одорантом, его ведь там в норме очень мало, т.к. как порог чувствительности офигенно мал. Хотя я и не уверен, мало ли сколько его напихать могут. Ну и потом, с чего это по трубам подают чистый метан? Все равно есть какие-то ядовитые примеси. Doudnick_Val 22:00, 6 февраля 2013 (UTC)
- Отменено исправление. Про неядовитость метана Александр может рассказать всем отравившемся этим неядовитым метаном. А они с интересом посшушают. —Tretyak 08:24, 18 января 2012 (UTC)
- Народ.
У людей, работающих в шахтах или на производствах, где в воздухе присутствуют в незначительных количествах метан и другие газообразные парафиновые углеводороды, описаны заметные сдвиги со стороны вегетативной нервной системы (положительный глазо-сердечный рефлекс, резко выраженная атропиновая проба, гипотония) из-за весьма слабого наркотического действия этих веществ, сходного с наркотическим действием диэтилового эфира.
- Причем тут непосредственно метан? Там в основном сказывается действие этих самых других алканов, бутана, пропана например. Сам метан если и оказывает какое-либо влияние на человека (я не говорю об вытеснении кислорода, это свойство присуще многим других газам), то настолько мизерное, что и в счет оно идти не может. Doudnick_Val 22:00, 6 февраля 2013 (UTC)
Стрелка или знак равенства[править код]
Я, может быть, не до конца осведомлен в этом вопросе, но мне казалось, что в органической химии нельзя ставить знак равенства. Но в статье реакция метана с хлором написана именно с этим знаком.Vityavo 13:07, 28 ноября 2010 (UTC)
- Можно, но осторожно. В данном случае это не критично. Doudnick_Val 14:27, 11 апреля 2013 (UTC)
Пока эти озёра не открыты, вряд ли следует писать, что они известны.
- Согласен, но здесь надо просто переформулировать. Doudnick_Val 14:28, 11 апреля 2013 (UTC)
«…из-за наличия глубоких вращательных полос поглощения его молекул в инфракрасном спектре». Насколько мне известно у метана с вращательными полосами туговато. Поскольку он не имеет пост. дипольного момента он не имеет нормальных вращательных полос поглощения. А т.к. к тому же не обладает анизотропной поляризуемостью, не активен и в КР спектрах. Может быть конечно имеют место какие-то возмущения, которые снимают запрет на такие переходы, но думаю они не могут внести весомый вклад в поглощение ИК излучения, которое к тому же соответствует колебательным переходам. Может всё-таки его парниковая активность связана с наличием у него более насыщенного спектра в ИК области чем у воды: 9 мод колебаний против 3? 178.88.24.90 10:30, 7 ноября 2012 (UTC)Кирилл
Хотя с девятью модами я погорячился:) Активны всего 4. Насчёт интенсивности поглощения ничего сказать не могу. Есть тут спектроскописты вообще? 178.88.24.90 10:49, 7 ноября 2012 (UTC)Кирилл
Сообщите статьи или источники, где указано,что атмосферы планет-гигантов солнечной системы почти полностью состоят из метана. Это явный ляп,основные составляющие их атмосфер водород и гелий. —Minamoto no Yoshinaka 21:19, 9 февраля 2014 (UTC)
- Уточнил, привел ссылку. Д.Ильин 23:02, 9 февраля 2014 (UTC).
Физические свойства метана почти не приведены. Такие как давление кипения при нормальной температуре и пр. Сейчас метан широко пропагандируется как топливо для автомобилей, якобы он сильно отличается от пропана-бутана по многим показателям в лучшую сторону, так вот хотелось бы ну хоть как-то сравнивать…
Спасибо.
Incredi 10:43, 29 марта 2014 (UTC)Игорь
Может стоит как-то стандартизировать в описании статьи про класс «алканов»?В смысле,что в все статьи про метан,этан,пропан,октан начинались одинаково:Предельный углеводород,алкан с общей формулой «С» умножь на два и прибавь два.В статье про метан вообще не упоминается ссылка,что он алкан.—Yan.gorev (обс.) 11:32, 12 июня 2019 (UTC)
Метан — это… Что такое Метан?
Мета́н (лат. Methanum) — простейший углеводород, бесцветный газ (в нормальных условиях) без запаха[2], химическая формула — CH4. Малорастворим в воде, легче воздуха. При использовании в быту, промышленности в метан обычно добавляют одоранты (обычно меркаптаны) со специфическим «запахом газа». Метан нетоксичен и неопасен для здоровья человека[3]. Однако имеются данные, что метан относится к токсическим веществам, действующим на центральную нервную систему[4]. Накапливаясь в закрытом помещении, метан взрывоопасен. Обогащение одорантами делается для того, чтобы человек вовремя заметил утечку газа. На промышленных производствах эту роль выполняют датчики и во многих случаях метан для лабораторий и промышленных производств остается без запаха.
Метан — первый член гомологического ряда насыщенных углеводородов (алканов), наиболее устойчив к химическим воздействиям. Подобно другим алканам вступает в реакции радикального замещения (галогенирования, сульфохлорирования, сульфоокисления, нитрования и др.), но обладает меньшей реакционной способностью. Специфична для метана реакция с парами воды, которая протекает на Ni/Al2O3 при 800—900 °C или без катализатора при 1400—1600 °C; образующийся синтез-газ может быть использован для синтеза метанола, углеводородов, уксусной кислоты, ацетальдегида и других продуктов.
Взрывоопасен при концентрации в воздухе от 4,4 % до 17 %[5]. Наиболее взрывоопасная концентрация 9,5 %. Является наркотиком; действие ослабляется ничтожной растворимостью в воде и крови. Класс опасности — четвёртый[6].
Источники
Основной компонент природных (77—99 %), попутных нефтяных (31—90 %), рудничного и болотного газов (отсюда другие названия метана — болотный или рудничный газ). В анаэробных условиях (в болотах, переувлажнённых почвах, рубце жвачных животных) образуется биогенно. Получается также при коксовании каменного угля, гидрировании угля, гидрогенолизе углеводородов в реакциях каталитического риформинга.
Классификация по происхождению:
- абиогенный — образован как результат химических реакций неорганических соединений;
- биогенный — образован как результат химической трансформации органического вещества;
- бактериальный (микробный) — образован в результате жизнедеятельности бактерий;
- термогенный — образован в ходе термохимических процессов.
Предположительно, что на поверхности Титана (спутник Сатурна) в условиях низких температур (−180 °C) существуют целые озёра и реки из жидкой метано[источник не указан 27 дней]-этановой смеси.
Получение
В лаборатории получают нагреванием натронной извести (смесь гидроксидов натрия и кальция) или безводного гидроксида натрия с ледяной уксусной кислотой.
Для этой реакции важно отсутствие воды, поэтому и используется гидроксид натрия, так как он менее гигроскопичен.
Возможно получение метана сплавлением ацетата натрия с гидроксидом натрия[7]:
Также для лабораторного получения метана используют гидролиз карбида алюминия или некоторых металлорганических соединений (например, метилмагнийбромида).
Химические свойства
Горит в воздухе голубоватым пламенем, при этом выделяется энергия около 39 МДж на 1 м³. С воздухом образует взрывоопасные смеси при объёмных концентрациях от 5 до 15 процентов. Точка замерзания −184oС (при нормальном давлении)
Вступает с галогенами в реакции замещения, которые проходят по свободно радикальному механизму:
Выше 1400 °C разлагается по реакции:
Окисляется до муравьиной кислоты при 150—200 °C и давлении 30—90 атм. по цепному радикальному механизму:
Соединения включения
Метан образует соединения включения — газовые гидраты, широко распространенные в природе.
Применение метана
- Топливо.
- Сырьё в органическом синтезе.
Физиологическое действие
Метан является самым физиологически безвредным газом в гомологическом ряду парафиновых углеводородов. Физиологическое действие метан не оказывает и не ядовит (из-за малой растворимости метана в воде и плазме крови и присущей парафинам химической инертности). Погибнуть человеку в воздухе, с высокой концентрацией метана можно только от недостатка кислорода в воздухе для дыхания при очень высоких концентрациях метана. Так, при содержании в воздухе 25—30 % метана появляются первые признаки асфиксии (учащение пульса, увеличение объёма дыхания, нарушение координации тонких мышечных движений и т. д.). Более высокие концентрации метана в воздухе вызывают у человека кислородное голодание — головную боль, одышку, — симптомы, сходные с горной болезнью.
Так как метан легче воздуха, он не скапливается в проветриваемых подземных сооружениях. Поэтому весьма редки случаи гибели людей от вдыхания смеси метана с воздухом, от асфиксии.
Первая помощь при тяжелой асфиксии: удаление пострадавшего из вредной атмосферы. При отсутствии дыхания немедленно (до прихода врача) искусственное дыхание изо рта в рот. При отсутствии пульса — непрямой массаж сердца.
Хроническое действие метана
У людей, работающих в шахтах или на производствах, где в воздухе присутствуют в незначительных количествах метан и другие газообразные парафиновые углеводороды, описаны заметные сдвиги со стороны вегетативной нервной системы (положительный глазо-сердечный рефлекс, резко выраженная атропиновая проба, гипотония) из-за весьма слабого наркотического действия этих веществ, сходного с наркотическим действием диэтилового эфира.
Метан и экология
Является парниковым газом, в этом отношении, более сильным, чем углекислый газ, из-за наличия глубоких вращательных полос поглощения его молекул в инфракрасном спектре. Если степень воздействия углекислого газа на климат условно принять за единицу, то парниковая активность метана составит 21 единицу[8].
ПДК метана в воздухе рабочей зоны составляет 7000 мг/м3[9].
Ссылки
Примечания
- ↑ Обзор: Растворимость некоторых газов в воде
- ↑ Статья «Метан» на сайте «Химик»
- ↑ З. Гауптман, Ю. Грефе, Х. Ремане «Органическая химия», М. «Химия», 1979, стр. 203.
- ↑ Куценко С. А. Основы токсикологии / С.А. Куценко. — СПб.: Фолиант, 2004.
- ↑ ГОСТ Р 52136-2003
- ↑ Газохроматографическое измерение массовых концентраций углеводородов: метана, этана, этилена, пропана, пропилена, н-бутана, альфа-бутилена, изопентана в воздухе рабочей зоны. Методические указания. МУК 4.1.1306-03 (УТВ. ГЛАВНЫМ ГОСУДАРСТВЕННЫМ САНИТАРНЫМ ВРАЧОМ РФ 30.03.2003)
- ↑ Б. А. Павлов, А. П. Терентьев. Курс органической химии. — Издание шестое, стереотипное. — M.: Химия, 1967. — С. 58.
- ↑ EBRD Methodology for Assessment of Greenhouse Gas Emissions, Version 3 February 2009 (англ.)
- ↑ Гигиенические нормативы ГН 2.2.5.1313-03 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны»